Евгений Александрович Корнюшенков — кандидат биологических наук, заведующий Клиникой экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, главный врач ветеринарной клиники «Биоконтроль».
Дмитрий Евгеньевич Митрушкин — кандидат биологических наук, cтарший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, патоморфолог ветеринарной клиники «Биоконтроль».
Дмитрий Валентинович Гаранин — кандидат биологических наук, ведущий хирург ветеринарной клиники «Биоконтроль»
Анна Леонидовна Кузнецова — кандидат биологических наук, cтарший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, ветеринарный врач, ведущий онколог ветеринарной клиники «Биоконтроль».
Екатерина Анатольевна Фатеева — старший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, реабилитолог, руководитель отделения реабилитации ветеринарной клиники «Биоконтроль»
Ксения Валерьевна Лисицкая — кандидат биологических наук, онколог-морфолог ветеринарной клиники «Биоконтроль»
Ольга Сергеевна Елизарова — ассистент ветеринарного врача ветеринарной клиники «Биоконтроль»
Ксения Александровна Тихонова — ассистент ветеринарного врача ветеринарной клиники «Биоконтроль»
Аннотация
Группе собак, 25 голов, проводили комбинированное лечение аппендикулярной остеосаркомы, включавшее химиотерапию «Цисплатином» (60-70 мг/м2, внутривенно, капельно, с интервалом (14-21) день, суммарно до 4-х циклов) и широкую сегментарную резекцию поражённой кости с замещением дефекта аллогенным имплантатом, заселённым клеточной культурой аутогенного костного мозга. Оценивали общую выживаемость, выживаемость без прогрессирования и частоту местных рецидивов в группе.
Медиана общей выживаемости в группе составила 321 день, медиана выживаемости без прогрессирования – 222 дня. Установлено 4 случая местных рецидивов (16,6 %), из которых 2 диагноза имеют морфологическое подтверждение, а 2 установлены по клинико-рентгенологическим данным.
Эффективность комбинированного органосохранного лечения аппендикулярных остеосарком у собак сравнима с таковой при проведении ампутаций (основываясь на данных научной литературы) и обеспечивает более высокое качество жизни животных.
Введение
Среди опухолей костей у собак наиболее распространённой первичной опухолью является остеосаркома ОС (80-85 % случаев). Этиология заболевания неизвестна. Предрасположены собаки крупных и гигантских пород, среднего возраста, без половой предрасположенности. Выявлены породы, ассоциированные с высоким риском развития ОС: сенбернар, ирландский волкодав, ирландский сеттер, ротвейлер, немецкая овчарка, доберман-пинчер, боксёр, золотистый ретривер. Приблизительно в 75 % случаев ОС поражает аппендикулярный скелет (чаще его метафизы), из них до 40 % случаев опухоль локализуется в дистальном сегменте лучевой кости. Данное новообразование характеризуется быстрым ростом (с выраженной костной деструкцией и инвазией в прилежащие мягкие ткани) и очень высоким метастатическим потенциалом. Собак с данным диагнозом без лечения эвтаназируют, или они погибают чаще вследствие метастатического поражения лёгких и выраженной болезненности затронутой кости в течение (16-20) недель после постановки диагноза [3, 4, 7, 8].
Ампутация больной конечности длительное время являлась наиболее распространённым (и едва ли не единственным) хирургическим методом лечения. Она имеет целый ряд преимуществ: обеспечивает полное удаление первичной опухоли практически во всех случаях (вследствие чего исключается вероятность рецидива), быстрое облегчение боли, сравнительно короткое время анестезии, низкий риск операционных и послеоперационных осложнений, быструю реабилитацию и относительно невысокую финансовую стоимость. Среднее время выживаемости собак с диагнозом «аппендикулярная ОС» после проведённой ампутации (без химиотерапии ХТ и лучевой терапии ЛТ) при отсутствии рентгенологически выявленных метастазов на момент операции составляет 4 месяца. В настоящее время комбинированное лечение аппендикулярной ОС посредством хирургии (ампутации или органосохранной операции) и ХТ обеспечивает наибольшую выживаемость таких пациентов (её медиана — (235-366) дней).
Однако ампутация конечности имеет и существенные недостатки. Её нельзя проводить при наличии ортопедической и/или неврологической патологии у какой-либо другой конечности/конечностей или выраженного ожирения. Также отсутствие грудной конечности у крупной или гигантской собаки резко снижает её способность к передвижению. Таким образом, становится актуальным проведение органосохранной операции [5, 9].
В настоящее время в онкологии применяют следующие методы для реконструкции резецированной кости, пораженной опухолью: металлический протез, наружный чрезкостный остеосинтез (с помощью дистракционно-компрессионных аппаратов), интраоперационное экстракорпоральное облучение либо пастеризация собственной кости, поражённой опухолью, транспозиция локтевой кости и аллогенный трансплантат (биоимплантат). Последний представляет собой прошедшую предварительную обработку длинную трубчатую кость, циркулярно фиксируемую металлическими пластинами. Эти методы, в большинстве случаев, позволяют отказаться от выполнения калечащей операции (ампутации) и провести органосохранную операцию, чтобы добиться хорошего или отличного функционирования конечности у 80 % собак с аппендикулярной ОС.
Подходящими пациентами для органосохранных операций являются такие собаки, у которых опухоль поражает менее 50 % длины кости, отсутствует или имеется минимальная инвазия в прилежащие мягкие ткани, не существует патологический перелом либо признаки метастазирования. Медиана выживаемости при таких операциях у собак сопоставима с медианой выживаемости при ампутации (как с адъювантной ХТ в обоих случаях, так и без неё). Вне зависимости от материала, замещающего кость, в послеоперационном периоде имеется вероятность таких осложнений, как несостоятельность имплантата (в (20-40) % случаев), инфицирование операционной области (в (30-50) % случаев) и рецидив опухоли (до 28 % случаев), вследствие чего потребуется реоперация [2, 4, 6, 7, 8, 10].
Целью данного исследования явился анализ выживаемости и случаев рецидивирования ОС аппендикулярного скелета у собак после органосохранных операций с применением биоимплантата (деиммунизированной аллогенной кости, заселённой мезенхимальными стромальными клетками реципиента). Методика получения такого биосовместимого имплантата подробно описана в статье Анисимовой Н.Ю. и соавторов [1]. Суть методики заключается в том, что отпрепарированным от мягких тканей длинным трубчатым костям взрослых эвтаназированных собак (вследствие полученных травм, несовместимых с жизнью) проводили перфорацию в трёх участках: в метафизах и центре диафиза. Следующим этапом проводилась их деиммунизация посредством полного погружения в (5-10) % раствор, приготовленный из сухой смеси хлорита натрия, перхлората натрия, хлорида натрия в соотношении 7:2:1 и дистиллированной воды, в течение (2-4) месяцев. Затем подготовленный костный матрикс многократно промывали стерильным 0,9 % раствором хлорида натрия и колонизировали мультипотентными мезенхимальными стромальными клетками, выделенными из костного мозга реципиента.
Материалы и методы
В исследование было включено 25 пациентов, в срок с 2013-го по 2017-й год получавших лечение в клинике экспериментальной терапии ФГБУ «НМИЦО им Н.Н. Блохина» Минздрава России по поводу ОС аппендикулярного скелета методом органосохранной операции с применением биоимплантата. Возраст животных составлял от 2-х до 13-ти лет, из них в возрасте (2-5) лет – 4 случая, (6-8) лет – 9 случаев, (9-13) лет – 12 случаев. 12 пациентов были самцами, 13 – самками. Породное распределение было следующим: метис – 4 пациента, боксер – 3 пациента, доберман – 3 пациента, американский бульдог – 2 пациента, ротвейлер – 2 пациента, бульмастиф – 1 пациент, дратхаар – 1 пациент, кане-корсо – 1 пациент, курцхаар – 1 пациент, маремма – 1 пациент, московская сторожевая – 1 пациент, немецкая овчарка – 1 пациент, ризеншнауцер – 1 пациент, среднеазиатская овчарка – 1 пациент, тибетский мастиф – 1 пациент, черный терьер – 1 пациент.
Во всех случаях был установлен и морфологически верифицирован диагноз ОС. Стадия заболевания Ia (высокодифференцированная опухоль, не выходящая за пределы надкостницы) установлена у одного животного, стадия IIа (низкодифференцированная опухоль, не выходящая за пределы надкостницы) у одного животного, стадия IIb (низкодифференцированная опухоль, выходящая за пределы надкостницы) – у 23-х. У 15-ти животных опухоль поражала лучевую кость, у 4-х живот- ных – локтевую кость, у 3-х животных – большеберцовую кость, у 2-х животных – бедренную кость и у одного животного – плечевую кость.
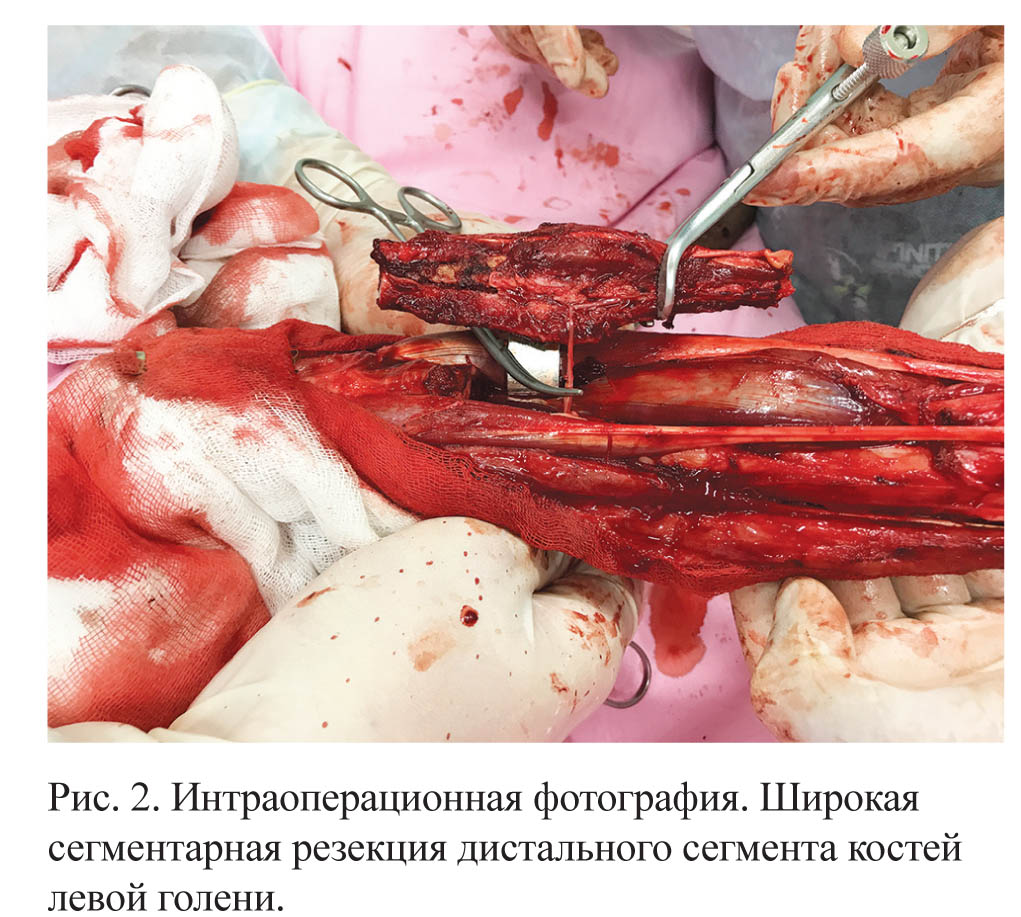
Всем животным на первом этапе лечения проводилась неоадъювантная ХТ «Цисплатином» в дозе (60–70) мг/м2 внутривенно капельно с интервалом (14–21) день, всего (1–2) цикла. В дальнейшем у всех пациентов выполнялась органосохранная хирургическая операция в объеме широкой сегментарной резекции пораженной кости (граница резекции формировалась с зоной безопасности в 3 см от видимых границ опухоли) с последующим замещением дефекта аллогенным биоимплантатом.
В послеоперационном периоде проводилась адъювантная ХТ «Цисплатином» в дозе (60–70) мг/м2 внутривенно капельно с интервалом (14–21) день, суммарно до 4-х циклов с учетом неоадъювантного этапа лечения. При необходимости проводилась сопроводительная терапия препаратами железа, эритропоэтина, колониестимулирующих факторов, симптоматическая терапия.
После окончания лечения пациенты выписывались с рекомендациями по динамическому наблюдению, включающему в себя периодический осмотр, клиническое обследование, рентгенографию или КТ легких, УЗИ органов брюшной полости для контроля локального статуса и развития отдаленных метастазов.
Результаты и обсуждение
В процессе наблюдения опорная функция конечности у 20-ти пациентов (80 %) оценивалась как хорошая или отличная. Не было зафиксировано ни одного случая реакции отторжения аллогенного трансплантата.
На момент исследования у 17-ти пациентов методами клинического, инструментального обследования или при аутопсии выявлены признаки местного рецидива или метастазирования ОС. Из них местный рецидив в зоне операции зафиксирован у 4-х пациентов, метастазирование в легкие – у 9-ти пациентов, метастазирование в кости – у 4-х пациентов, метастазирование в печень – у 2-х пациентов и метастазирование в регионарные лимфатические узлы – у 1-го пациента.
Клиническими признаками местного рецидивирования являлась вновь возникшая или усиливающаяся хромота на оперированную конечность, визуально и пальпаторно определяемое объёмное образование мягкотканной или костной плотности в зоне первичной опухоли или прилежащих к ней отделах конечности. Рентгенологическими признаками рецидива являлась визуализация объёмного образования в послеоперационной области мягкотканной или костной плотности с признаками остеодеструкции, наличием периостальной реакции и патогномоничных рентгенологических симптомов, характерных для опухоли кости.
Морфологическая верификация местного рецидива проводилась только по данным аутопсии погибших животных.
21 пациент на момент исследования умер либо эвтаназирован, из них 6-ти животным выполнена аутопсия. По результатам патологоанатомического исследования установлено, что у трёх животных гибель наступила по причинам, не связанным с основным заболеванием, при этом у двух пациентов на патологоанатомическом вскрытии признаков местного рецидива и метастазов ОС обнаружено не было. В числе животных, не подвергшихся патологоанатомическому исследованию после смерти, следует выделить два случая, когда гибель наступила с клиникой хронической почечной недостаточности без установленных признаков местного рецидива или прогрессирования онкологического процесса.
На момент исследования 4 животных были живы, признаков местного рецидива и метастазирования ОС на момент последнего обследования выявлено не было.
Были проанализированы показатели общей выживаемости и выживаемости без прогрессирования в группе методом Каплана- Майера. Для общей выживаемости в качестве критерия цензурирования данных использовались случаи, в которых животное было живо на момент исследования, а для выживаемости без прогрессирования – случаи, в которых у пациента на момент последнего обследования отсутствовали признаки местного рецидива, регионарных или отдаленных метастазов ОС. Для общей выживаемости критерии цензурирования были дополнены случаями гибели животного от сопутствующей патологии, а для выживаемости без прогрессирования – только теми случаями, когда при аутопсии не было обнаружено ни рецидивной опухоли, ни метастазов остеосаркомы.
Была вычислена скорректированная по Каплану-Майеру медиана и квартили общей выживаемости и выживаемости без прогрессирования в группе. Медиана общей выживаемости в группе составила 321 день, 25-й процентиль составил 184 дня, 75-й процентиль – 605 дней. Медиана выживаемости без прогрессирования в группе составила 222 дня, 25-й процентиль – 129 дней, 75-й процентиль – 548 дней.
Результаты анализа выживаемости пациентов по Каплану-Майеру представлены в виде диаграмм:
На момент фиксации результатов исследования у 4-х пациентов методами клинического, инструментального обследования или при аутопсии выявлены признаки местного рецидива ОС; из них у 3-х животных рецидив выявлен прижизненно и у одного пациента – на аутопсии. В двух случаях принадлежность рецидивной опухоли установлена морфологически и в двух случаях – клинико-рентгенологическими методами. У 3-х животных местный рецидив констатирован в лучевой кости, у 1-го животного – в большеберцовой кости. К настоящему времени все пациенты с установленным местным рецидивом умерли или эвтаназированы.
Мы проанализировали безрецидивную выживаемость в группе с учетом только местных рецидивов методом Каплана-Майера. В качестве критерия цензурирования данных использовались случаи, в которых животное на момент окончания наблюдения или смерти не имело ни клинических, ни рентгенологических, ни морфологических признаков местного рецидива. Результаты анализа представлены в виде диаграммы:
Заключение
Полученные результаты позволяют оценить общую и безрецидивную выживаемость пациентов как сравнимую с данными иностранных исследователей, при этом качество жизни животных после органосохранной операции в целом выше по отношению к качеству жизни животных, подвергнутых ампутации конечности. Анализ графиков выживаемости также позволяет отметить, что приблизительно у 50-ти % пациентов отмечается прогрессирование заболевания в течение первых 150-ти дней после операции, вероятно, по причине наличия у них недиагностированных микрометастазов на момент первичного приема. У пациентов, переживших этот срок, фиксируется «вторая волна» рецидивов по прошествии (400–600) дней (1–1,5 года); таким образом, показатель однолетней безрецидивной выживаемости составляет 49 %, а 2-летней – около 15 %. При этом однолетняя общая выживаемость животных (составляя 50 %) лишь незначительно превышает безрецидивную, а 2-летняя общая выживаемость составляет 21 %.
При анализе графика частоты местного рецидивирования также можно предположить зависимость, сходную с указанной выше для прогрессирования заболевания: местные рецидивы фиксировались либо в течение первых 150-ти дней (50 % случаев), либо по истечении второго года наблюдения. В целом, частоту местного рецидивирования после комбинированного лечения ОС собак способом, указанным выше, можно оценить как небольшую (16,6 %).
Список литературы
- Анисимова Н.Ю. Стерильный деиммунизированный матрикс для замещения расширенных дефектов костной ткани. / Н.Ю. Анисимова, А.Н. Копылов, Е.А. Корнюшенков [и др.] // Саркомы костей, мягких тканей и опухоли кожи. 2013. № 2. С. 49–54.
- Корнюшенков Е.А. Новые пути решения проблемы замещения дефектов при обширной резекции у животных с опухолями костей / Е.А. Корнюшенков, Л.В. Голуб, Н.Ю. Анисимова [и др.] // Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2013. № 3. С. 12–16.
- Gassel A., Bilbrey S. Limb-sparing surgery for appendicular osteosarcoma in dogs // Vet Med. 2003. № 98. Р. 119–124.
- Jehn C. Current treatment options for dogs with appendicular osteosarcoma / C. Jehn, J. Farese, D. Lewis [et al.] // Vet Med. 2005. № 100. Р. 295–305.
- Lascelles B.D. Improved survival associated with postoperative wound infection in dogs treated with limbsalvage surgery for osteosarcoma / B.D. Lascelles, W.S. Dernell, M.T. Correa [et al.] // Ann Surg Oncol. 2005. № 12 (12). Р. 1073–83.
- Liptak J.M. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques / J.M. Liptak, W.S. Dernell, N. Ehrhart [et al.] // Vet Surg. 2006. № 35 (6). Р. 518–533.
- MacDonald T.L., Schiller T.D. Limb-sparing surgery using tantalum metal endoprosthesis in a dog with osteosarcoma of the distal radius // Can Vet J. 2010. № 51 (5). Р. 497–500.
- Mitchell K.E. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study / K.E. Mitchell, S.E. Boston, M. Kung [et al.] // Vet Surg. 2016. № 45 (1). Р. 36–43.
- Morello E. Bone allografts and adjuvant cisplatin for the treatment of canine appendicular osteosarcoma in 18 dogs / E. Morello, P. Buracco, M. Martano [et al.] // J Small Anim Pract. 2001. № 42 (2). Р. 61–66.
- Withrow S.J. Biodegradable cisplatin polymer in limb-sparing surgery for canine osteosarcoma / S.J. Withrow, J.M. Liptak, R.C. Straw [et al.] // Ann Surg Oncol. 2004. № 11 (7). Р. 705–713.