Цель исследования. Оценить влияние инфузии суспензии ЛАК (мононуклеарных лейкоцитов крови, активированных ИЛ-2 ex vivo) на клинические, биохимические, гематологические и иммунологические показатели здоровой собаки породы бигль, чтобы сделать вывод о безопасности применения данного продукта клеточных технологий.
Материалы и методы. Объект исследования — собака породы бигль, самец, возраст 6 лет. Суспензию ЛАК в растворе Хенкса в дозе 25 млн клеток в объеме 5 мл вводили внутривенно с малой скоростью. Исследовали аутологичную культуру ЛАК, генерированную из венозной крови собаки. Генерацию культуры и оценку морфологии, фенотипа, активности целевых ЛАК выполняли на базе лаборатории клеточного иммунитета НИИЭДиТО.
Результаты. Анализ гематологических и иммунологических параметров животного в сочетании с результатами рентгенологического исследования не выявил признаков развития каких-либо патологических процессов в организме животного после введения активированных клеток, можно сделать вывод об отсутствии местного или системного токсического воздействия ЛАК в данном количестве.
Выводы. Полученные в ходе проведенного исследования данные представляют интерес и для медицины человека и для ветеринарной медицины, поскольку могут рассматриваться как часть доклинических испытаний готового продукта — суспензии ЛАК, эффективность которой в клинической онкологии человека уже была подтверждена, и как пример оценки безопасности более сложных конструктов на основе активированных иммунокомпетентных клеток, еще находящихся в стадии разработки. Проведенные исследования могут послужить основой для разработки моделей изучения токсичности средств клеточной противоопухолевой иммунотерапии на основе активированных лейкоцитов (ЛАК, иммунные «checkpointmolecules» и СAR), а также рассматриваться как часть доклинических исследований токсичности ЛАК.
Ключевые слова: собака, ЛАК, иммунотерапия, онкологические заболевания, иммунный ответ.
Сокращения: ДК — дендритные клетки, ИЛ — интерлейкин, ЛАК — лимфокинактивированные киллеры,тНК — натуральные киллеры, ППС — полная питательная среда, Т — температура тела, ЧСС — частота сердечных сокращений, ЧД — частота дыхания, МТТ — 3- (4,5-диметилтиазол-2) — 2,5-дифинилтетразолиум бромид.
Авторы
Екатерина Анатольевна Фатеева — старший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, реабилитолог, руководитель отделения реабилитации ветеринарной клиники «Биоконтроль»
Евгений Александрович Корнюшенков — кандидат биологических наук, заведующий Клиникой экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, главный врач ветеринарной клиники «Биоконтроль».
Дмитрий Евгеньевич Митрушкин — кандидат биологических наук, cтарший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, патоморфолог ветеринарной клиники «Биоконтроль».
Дмитрий Валентинович Гаранин — кандидат биологических наук, ведущий хирург ветеринарной клиники «Биоконтроль»
Анна Леонидовна Кузнецова — кандидат биологических наук, cтарший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, ветеринарный врач, ведущий онколог ветеринарной клиники «Биоконтроль».
Максим Викторович Родионов — кандидат медицинских наук, старший научный сотрудник Клиники экспериментальной терапии ФГБУ «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Минздрава России, врач-радиолог клиники “Биоконтроль”
Михаил Валентинович Киселевский — доктор медицинских наук, профессор, заведующий лабораторией клеточного иммунитета НИИ экспериментальной диагностики и терапии опухолей ФГБУ «Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина» Минздрава России
Наталья Юрьевна Анисимова — доктор биологических наук, ведущий научный сотрудник лаборатории клеточного иммунитета НИИ экспериментальной диагностики и терапии опухолей ФГБУ «Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина» Минздрава России
Введение
В настоящее время клеточная иммунотерапия все чаще используется в клинической практике лечения пациентов с онкологическими заболеваниями. В основе данного подхода лежит выделение из организма донора или самого больного иммунокомпетентных клеток, их культивация ex vivo с целью пролиферации, активации различными биоактивными агентами экзо- и эндогенного происхождения, и, наконец, последующего введения в организм больного. Использование данного подхода позволяет получать различные продукты клеточных технологий; некоторые такие продукты были успешно апробированы в клинической онкологии человека. В частности, для лечения фолликулярной и диффузной неходжкинских лимфом применяют препарат ритуксимаб, который представляет собой химерные моноклональные антитела, специфичные к CD20 — антигену, обнаруживаемому на мембране B-лимфоцитов [1]. В составе комплексного лечения пациентов с меланомой, как в медицине человека, так и в ветеринарной практике, применяется вакцина на основе дендритных клеток, индуцирующая активацию иммунного ответа, опосредуемого Т-лимфоцитами. Как было показано в серии исследований in vitro и in vivo, ДК способны активировать в организме как неспецифический, опосредуемый НК, так и специфический противоопухолевый иммунный ответ, опосредованный Т-лимфоцитами. В последнее время большие надежды в борьбе с онкологическими заболеваниями связаны с применением специфических антител, таких как PD-1 (от англ. programmed cell death protein 1) и CTLA-1 (от англ. cytotoxic T-lymphocyte — associated antigen 4). Было показано, что применение указанных специфических антител блокирует PD-1 и CTLA-1 — опосредованные сигнальные пути в Т-лимфоцитах, активируя специфический иммунный ответ, обусловленный цитототоксической реактивностью, антиген-презентирующей и цитокин-индуцирующей функциями.
Важно помнить, что иммунотерапия наиболее эффективна после процедуры циторедукции и, кроме того, ее успех во многом зависит от качества оперативного вмешательства и / или лучевой терапии. Следует отметить, что применение продуктов клеточных технологий рассматривается как эффективный инновационный подход для лечения в аддитивном режиме пациентов со злокачественными опухолями, осложненными развитием опухолевых серозитов.
В частности, имеется значительное число публикаций о положительном опыте применения в клинической практике ЛАК против опухолевых асцитов, плевритов, перикардитов.
Вышеизложенное справедливо и для ветеринарной медицины, где высока потребность в новых эффективных иммунотропных средствах борьбы с онкологическими заболеваниями. Известно, что только в США каждый год у 6 миллионов собак регистрируют онкологические заболевания. Однако в настоящее время число публикаций о разработке и оценке новых средств клеточной иммунотерапии с противоопухолевой активностью остается небольшим. При этом обоснованность большинства из предложенных методов противоопухолевой иммунотерапии базируется на экстраполяции результатов, полученных специалистами медицины человека. Было отмечено, что средств иммунотерапии, созданных с помощью клеточных технологий, разработанных и апробированных специально для лечения собак и кошек, пока очень мало. В основном, немногочисленные данные об эффективности применения рассматриваемых инновационных продуктов были получены в ходе тестирования на этих животных разработок, предназначенных для медицины человека. В частности, на собаках были протестированы противоопухолевые вакцины и один из типов генетически модифицированных антигенспецифических Т-клеток. Однако вопросам оценки безопасности для собак разрабатываемых клеточных продуктов внимания было уделено в объеме, недостаточном для формирования картины развития возможных осложнений.
Цель исследования
Оценить влияние инфузии суспензии ЛАК (мононуклеарных лейкоцитов крови, активированных ИЛ-2 ex vivo) на клинические, биохимические, гематологические и иммунологические показатели здоровой собаки породы бигль, чтобы сделать вывод о безопасности применения данного продукта клеточных технологий, а также о путях коррекции стратегии его применения в клинической ветеринарной практике. Методы генерации и идентификации ЛАК, режим введения и дозировка клеток были определены на основе предварительных исследований.
Материалы и методы
Объект исследования — собака породы бигль, самец, возраст 6 лет.
Непосредственно перед началом, а также в процессе эксперимента собака содержалась в условиях стационара клиники экспериментальной терапии ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России на стандартном рационе, при свободном доступе к воде. Перед началом эксперимента было проведено комплексное исследование физиологических, биохимических и гематологических параметров собаки, которое показало, что животное на момент начала эксперимента находится в удовлетворительном состоянии, все биохимические и гематологические показатели в пределах физиологических норм. У животного были измерены ЧСС, ЧД, Т, систолическое и диастолическое давление, также были оценены показатели клеточного иммунитета (иммунофенотип лейкоцитов крови, НК-активность, фагоцитарная активность клеток крови). Также было проведено рентгенологическое исследование легких. Это позволило установить исходный (базовый) уровень изучаемых параметров.
Суспензию ЛАК в растворе Хенкса в дозе 25 млн клеток в объеме 5 мл вводили внутривенно с малой скоростью. За период введения не было отмечено признаков изменения реактивности, озноба, тремора, саливации, нарушений дыхания, объективных признаков боли, гиперемии конъюнктивы и слизистых покровов полости рта и носа. Затем в течение 5 суток проводили мониторинг физиологических параметров (первые 3 ч — каждые 15 минут, далее — каждые 12…24 часа), иммунологических и гематологических параметров (через 4 ч после введения ЛАК и через 48 ч). Динамику иммунологических параметров животного оценивали на базе лаборатории клеточного иммунитета НИИЭДиТО.
Исследовали аутологичную культуру ЛАК, генерированную из венозной крови собаки. Генерацию культуры и оценку морфологии, фенотипа, активности целевых ЛАК выполняли на базе лаборатории клеточного иммунитета НИИЭДиТО.
Венозную кровь собаки стабилизировали 3,8%-м раствором цитрата натрия (1,1 мл раствора на 9 мл крови), смешивали с раствором Хенкса (ПанЭко, РФ) 1:1, наслаивали на градиент фиколла (плотность 1,077) и центрифугировали 20 мин при 1500 мин-1, 20 °С. Затем собирали клетки на границе фаз и двукратно отмывали их средой RPMI-1640 (ПанЭко, РФ), центрифугируя пробирки при 300g в течение 5 мин. Выделенные лейкоциты суспендировали в ППС на основе RPMI-1640, содержащей 5% фетальной бычьей сыворотки (HyCloneLaboratories, Thermo), 2 мM L-глутамина, 100 мкг / мл пенициллина и 100 мкг / мл сульфата стрептомицина (ПанЭко, Россия).
Морфологию клеток оценивали с помощью световой микроскопии. Клетки подсчитывали в камере Горяева после окрашивания трипановым синим (ПанЭко, РФ). Клеточную суспензию разливали в 3 флакона Nung по 10 мл. В два флакона для генерации ЛАК добавляли препарат рекомбинантного ронколейкина (500 МЕ / мл), третий оставляли без дополнительных добавок в качестве контроля лейкоцитов. Флаконы с клетками культивировали в течение 3 суток в СО2-инкубаторе NUAir при 37 °С, 5% СО2.
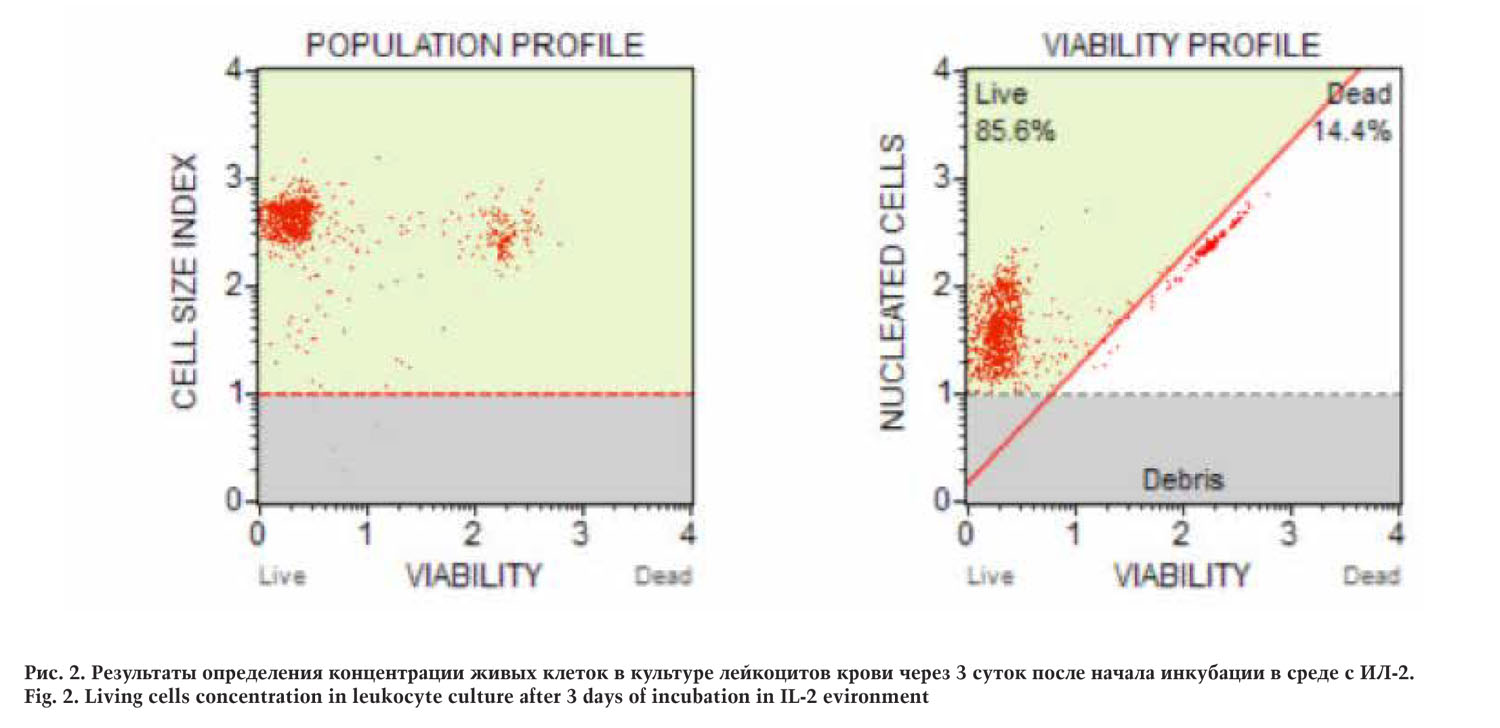
По окончании срока инкубации клетки отмывали от ростовой среды центрифугированием в течение 5 минут при 300g. Осадок ресуспендировали в растворе Хенкса. Затем на клеточном анализаторе MuseMillipore определяли количество живых клеток.
Согласно полученным данным, концентрация целевых клеток в культуре соответствовала 3,77×106 в 1мл. Жизнеспособность ЛАК соответствовала 85,6%. Следовательно, концентрация живых клеток соответствовала 3,23×106 в 1мл. Общий объем составил 10 мл. Подготовленная клеточная суспензия была использована для характеристики свойств ЛАК конечной генерации и для введения собаке.
Для морфологических и цитологических исследований посредством световой микроскопии использовали приборы Axioplan 2 CarlZeiss и Axiovert 40 СFL CarlZeiss. Концентрацию клеток определяли при рутинном подсчете в камере Горяева после окрашивания трипановым синим (ПанЭко, РФ). Иммунофенотип клеток оценивали по экспрессии ряда поверхностных маркеров с помощью моноклональных антител, конъюгированных с флуорохромами, на цитофлюориметре BD Canto II (BectonDickinson, USA). В качестве контроля использовали неиммунные, меченые FITC и ремоноклональные антитела того же изотипа, что и антитела против исследуемого маркера. В каждом образце анализировали не менее 10000 клеток. Оценивали относительное количество клеток, экспрессирующих целевые маркеры, а также интенсивность свечения (MFI) меченных клеточных популяций. Результаты проточной цитометрии анализировали в программе FACS Divaversion 3.1.0. Для подсчета количества живых и мертвых клеток использовали клеточный анализатор MuseMillipore и набор реактивов для него. Полученные с этого прибора результаты анализировали в программе
Muse 1.4 Analysis. НК-активность клеток — эффекторов (ЛАК и контрольных лейкоцитов) оценивали с помощью МТТ теста. В качестве клеток-мишеней использовали клетки миелоидного лейкоза человека линии К-562. Соотношение клеток-эффекторов и клеток-мишеней — 3 / 1. Длительность коинкубации — 48 ч. Результаты анализировали на планшетном ридере LabsystemMultiscanMS, ThermoSc., Finland
Первичные данные обрабатывали с использованием модуля «Базовая статистика», «Множественная регрессия» и «Непараметрическая статистика» пакета программ Statistica 6.0 (StatSoft). В качестве характеристик полученных выборок использовали среднее (χ), стандартное отклонение среднего (SD). Сравнительный анализ данных проводили с использованием t-критерия. Отличия считали достоверными при р< 0,05.
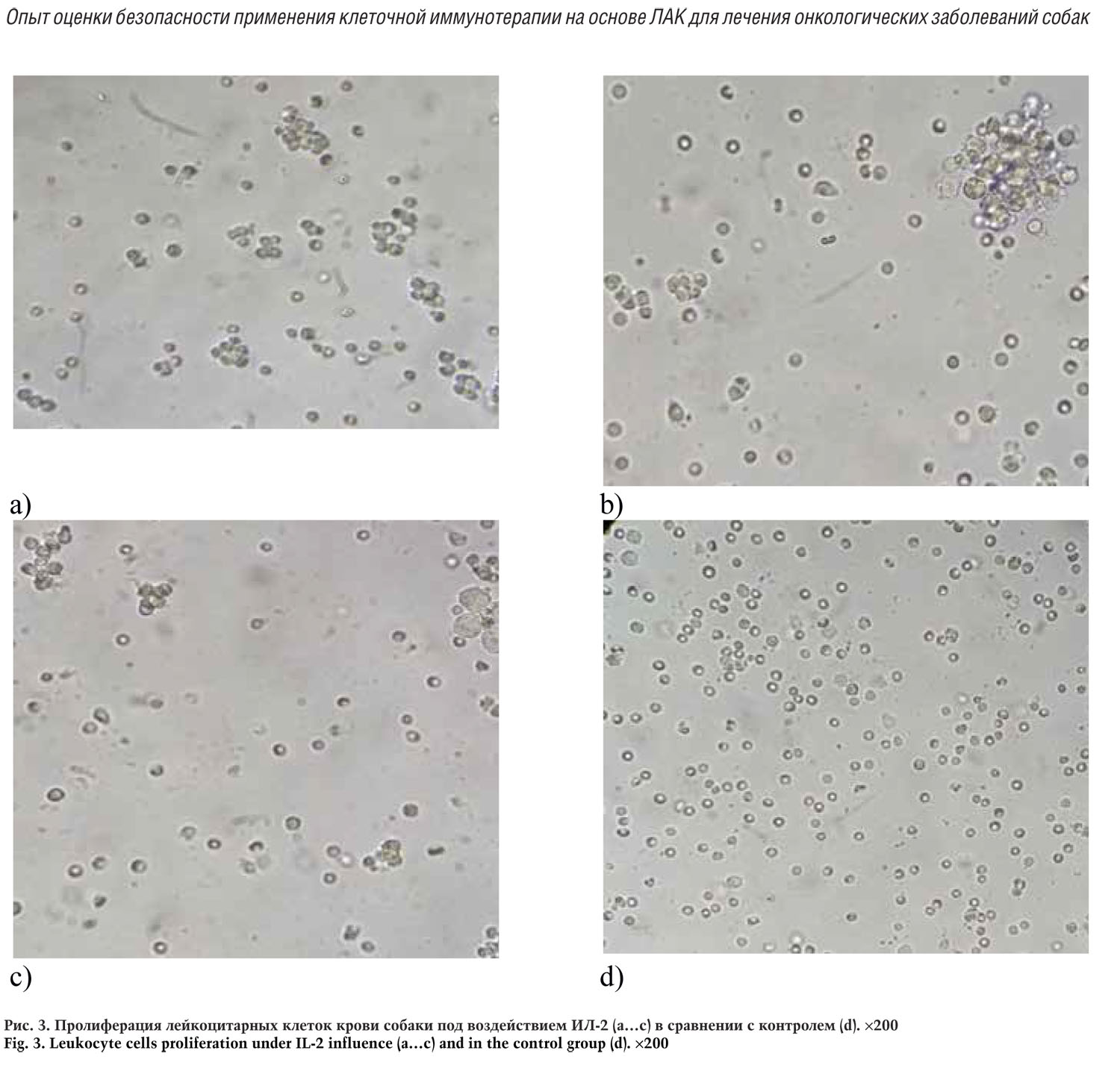
Данный параметр оценивали на 3-и сутки культивирования клеток с использованием световой инвертированной микроскопии нативной культуры
Продемонстрировано, что на момент регистрации результатов в культуре ЛАК отмечали наличие отдельных небольших клеточных конгломератов — 4…7 в поле зрения (увеличение ×200). В контрольном флаконе, где изолированные из крови лейкоциты инкубировали в среде без добавления ИЛ-2 формирование подобных пролифератов было отмечено в незначительном количестве — 0…1 в поле зрения, что свидетельствует о усилении пролиферативной активности лейкоцитарных клеток крови собак под воздействием ИЛ-2.
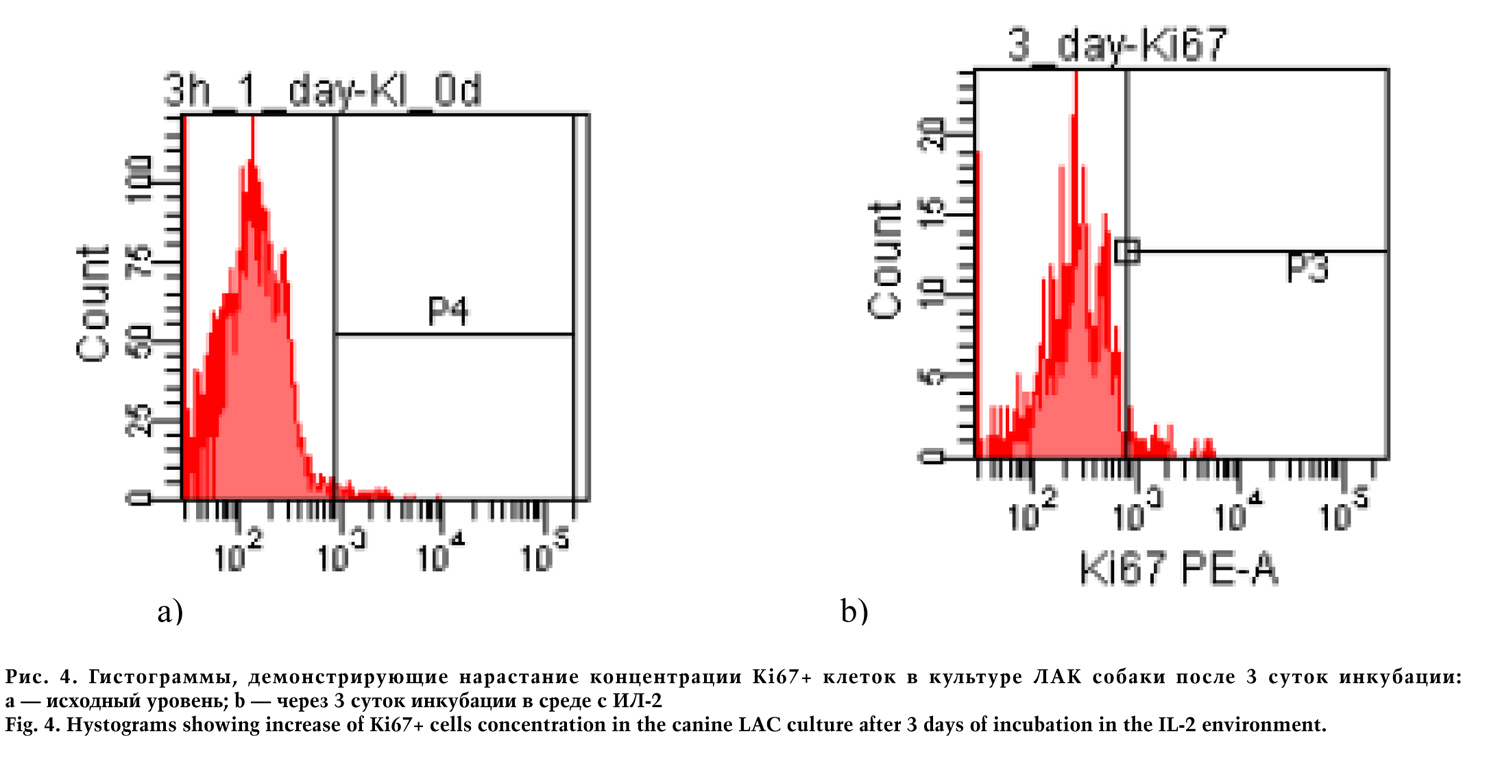
Чтобы оценить пролиферативную активность, исследовали динамику концентрации Ki67+ клеток в культуре ЛАК (3-и сутки инкубации) в сравнении с исходным уровнем (сразу после выделения лейкоцитов из крови собаки). Исследовали посредством проточной цитометрии на цитофлуориметре BDCantoII. Результат эксперимента рассчитывали, вычисляя среднее значение измерений в триплетах. Полученные данные указывают на достоверное увеличение пролиферации лейкоцитарных клеток под воздействием ИЛ-2: на 3-и сутки инкубации концентрация KI67+ клеток возросла в среднем 5,6 раз, р=0,016
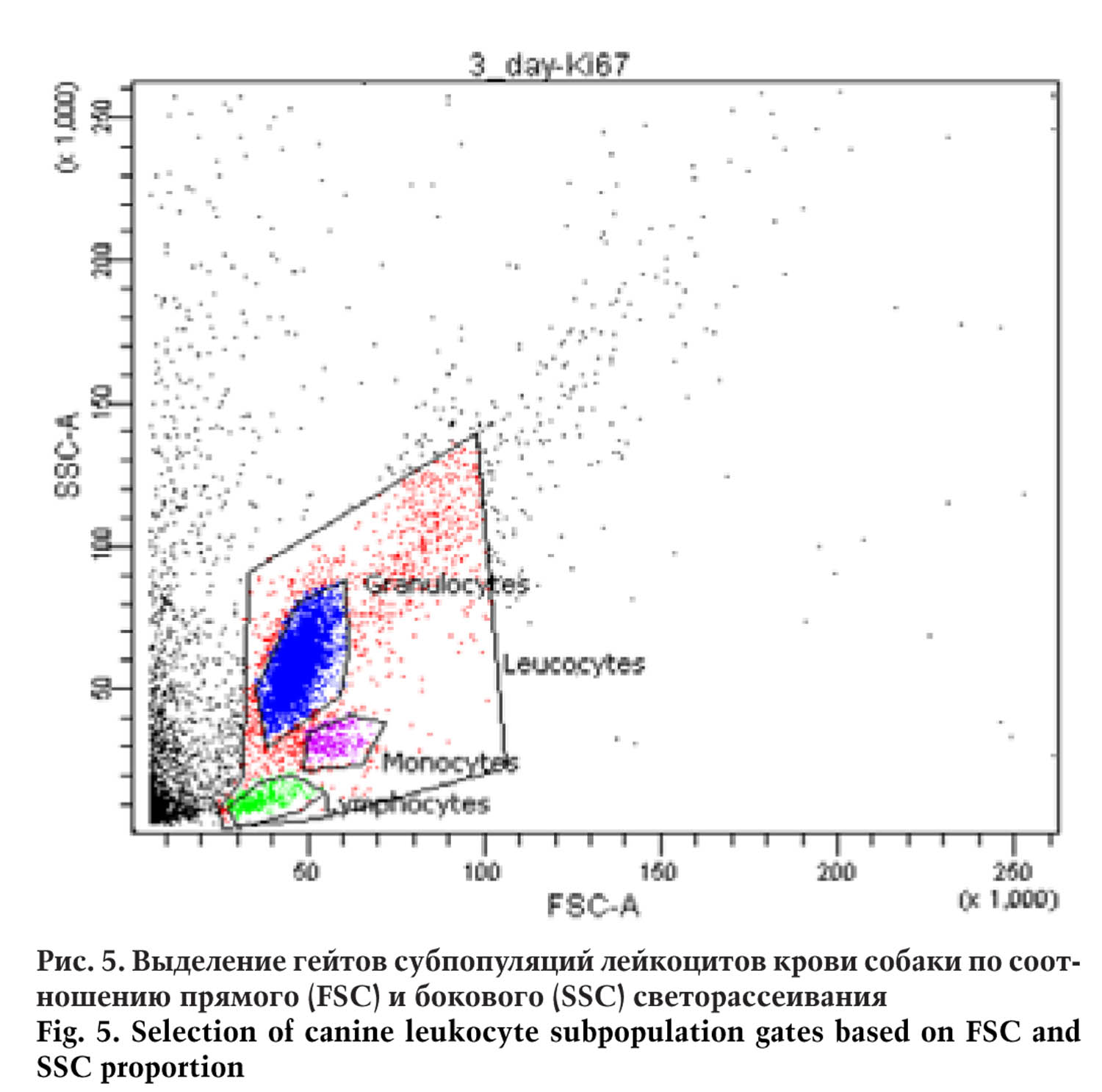
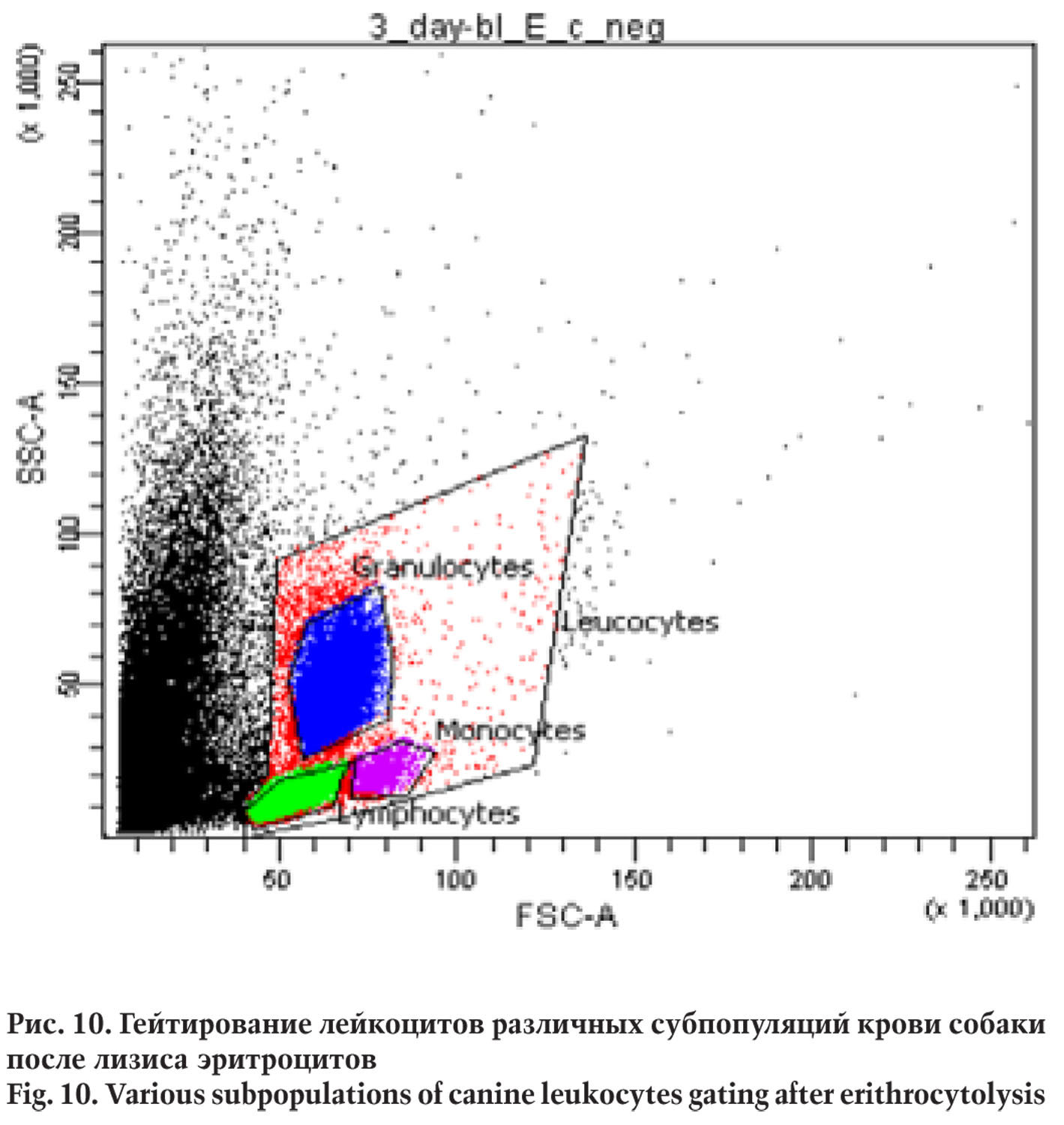
Фенотип ЛАК исследовали посредством проточной цитометрии на цитофлуориметре BDCantoII. На первом этапе по соотношению прямого и бокового светорассеивания были выделены гейты, соответствующие отдельным субпопуляциям лейкоцитов — лимфоцитам, моноцитам, гранулоцитам.
Использование такого подхода позволило оценить не только суммарное изменение уровня экспрессии маркеров на всех клетках культуры, но и вклад в него отдельных субпопуляций.
В процессе инкубации исследовали динамику экспрессии на клетках культуры молекул CD5 (маркер лимфоцитов), CD4 (маркер Т-хелперов, у собак экспрессируется также на гранулоцитах и моноцитах), CD8 (маркер Т-киллеров), CD25 (рецептор к ИЛ-2), CD34 (маркер низкодифференцированных гемопоэтических клеток).
В процессе инкубации лейкоцитов в среде с ИЛ-2 наблюдали значительное увеличение концентрации лимфоцитов (количество CD5+ клеток увеличилось в 11 раз) на фоне относительного снижения количества CD4+ клеток с 81,4% до 24,5% и возрастания уровня CD8a+ клеток с 0,85 до 8%
Измерение неспецифической противоопухолевой реактивности клеток, реализуемое за счет активности НК, после генерации в среде с ИЛ-2 оценивали в сравнении с эффективностью лейкоцитов в контроле, где клетки культивировали в ППС без ИЛ-2 в условиях, аналогичных ЛАК. Исследовали с использованием МТТ-колориметрического метода, оптическую плотность раствора формазана измеряли в триплетах на планшетном ридере MSMultiscan при 540 нм.
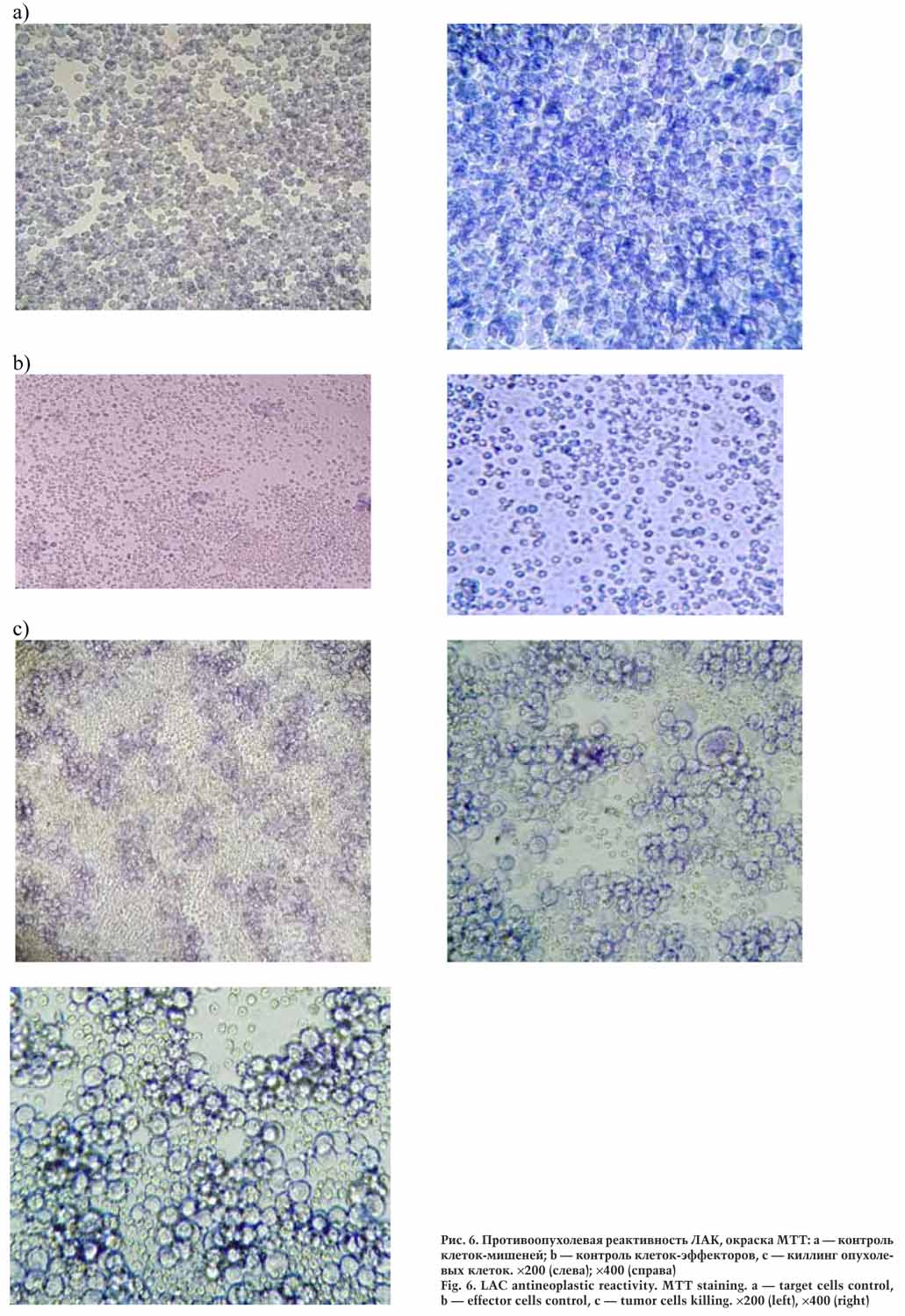
На рисунке 6 приведены фотографии морфологии клеток, полученные с использованием световой микроскопии после окраски МТТ.
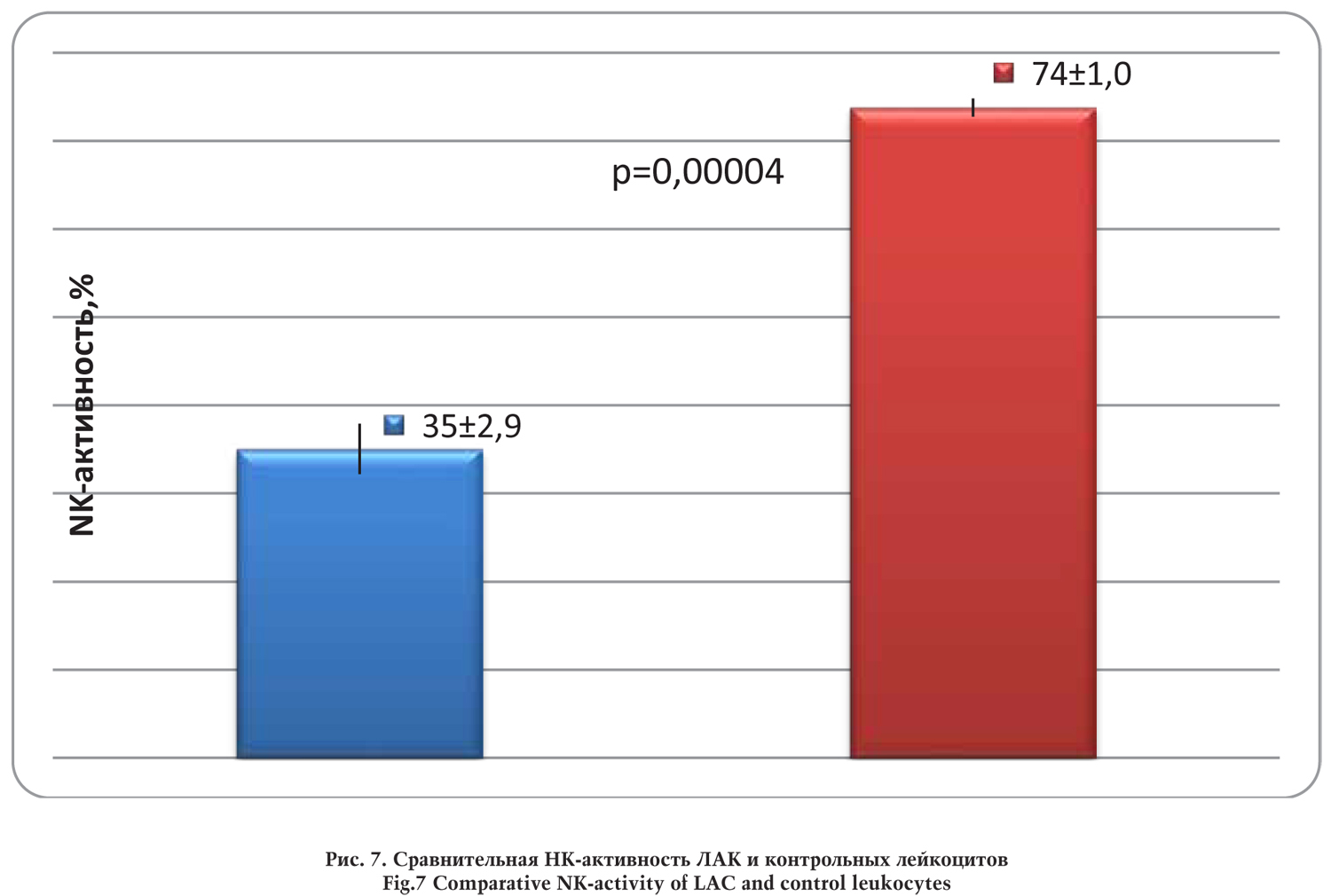
Было обнаружено достоверное (р<0,05) увеличение НК-активности ЛАК в сравнении с реактивностью контрольных лейкоцитов, культивируемых в отсутствии ИЛ-2.
При сравнении средних значений установлено, что неспецифическая противоопухолевая активность ЛАК превышала эффективность нестимулированных клеток более чем в 2 раза.
Результаты и обсуждение
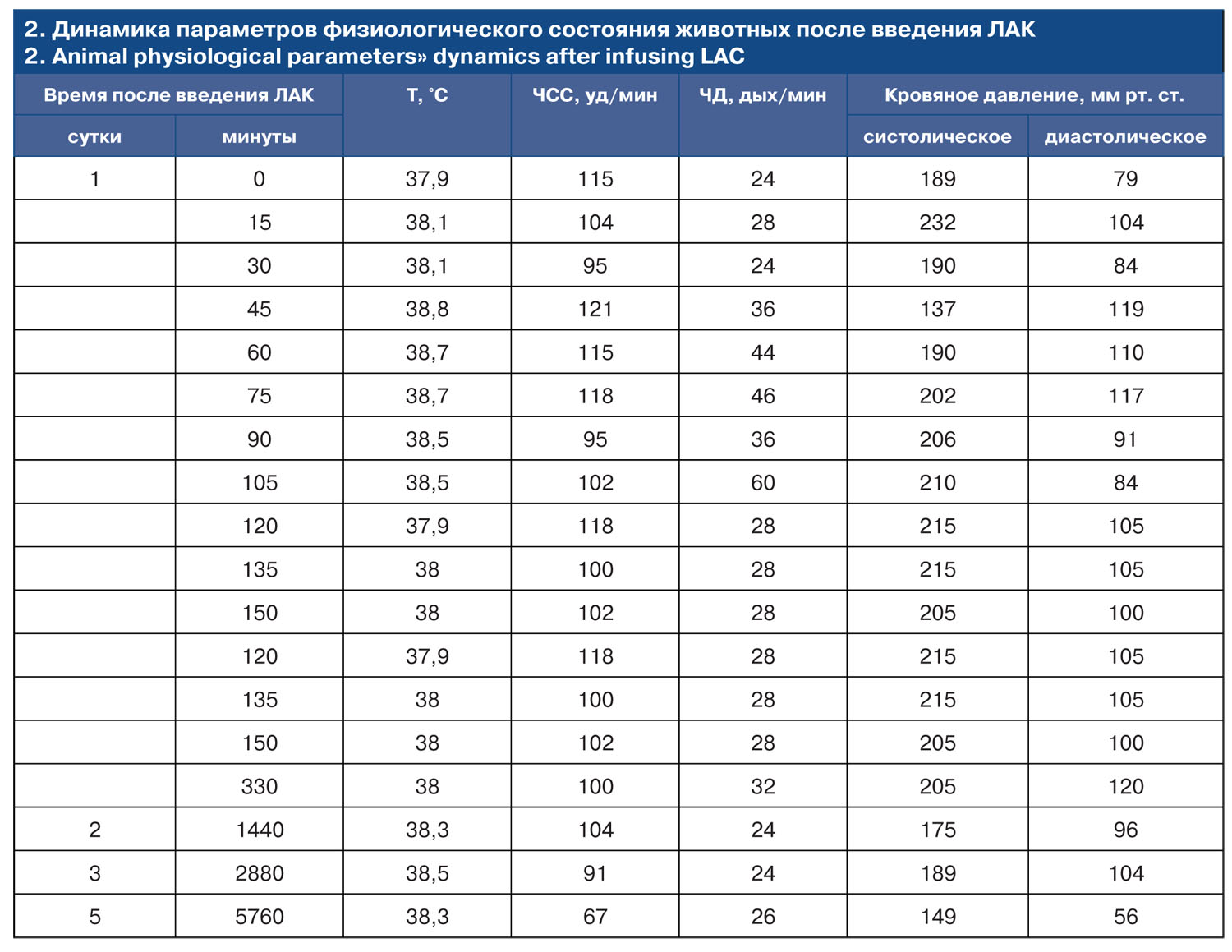
В процессе наблюдения за животным колебания оцениваемых параметров происходили в пределах нормативных показателей. Тем не менее, продемонстрирована тенденция относительно кратковременного периода (около 1 ч) колебания оцениваемых параметров, наблюдаемого в течение 45…105 минут после введения активированных клеток. В частности, через 45 минут после введения наблюдали тенденцию нарастания Т, ЧД, ЧCC, снижения систолического давления. После 120 мин наблюдали постепенную нормализацию этих показателей.
Аппетит и когнитивная реактивность животного не претерпели изменений в период наблюдения после введения ЛАК. Не отмечали признаков саливации, патологической жажды, отсутствия или извращения аппетита. Не отмечены какие-либо признаки местных или системных патологических реакций, свидетельствующих о развитии органной недостаточности.
Рентгенологическое исследование области грудной клетки собаки не показало формирование признаков развития патологических изменений тканей легких. В частности, не выявлено признаков диффузного уплотнения легочной ткани, наличия экссудата или транссудата в перикардиальной и плевральной полостях.
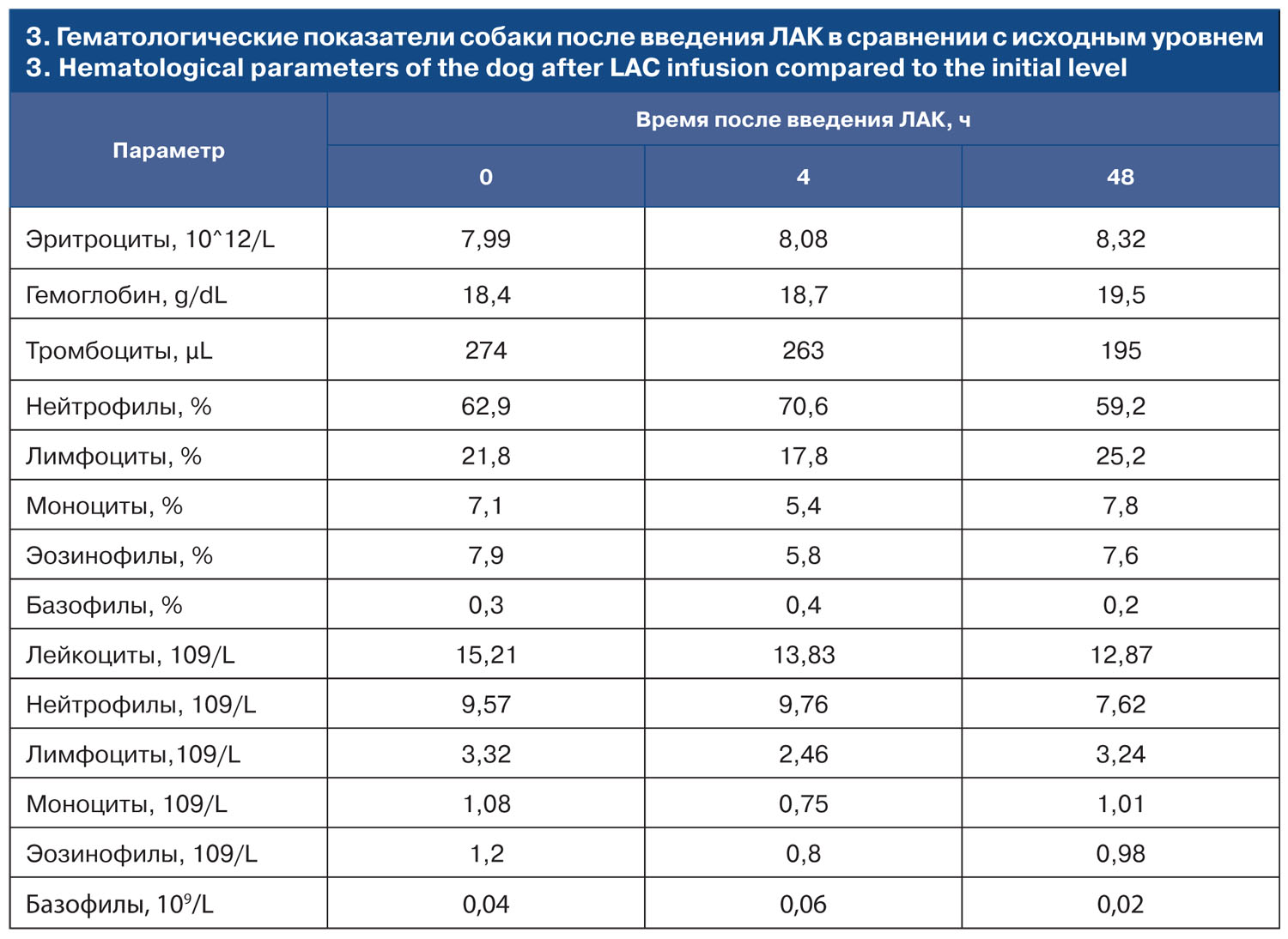
Контроль гематологических показателей был проведен на анализаторе IDEXXProCyteDx, откалиброванного для оценки клеток крови собак через 4 и 48 ч после введения ЛАК
Приведенные данные показывают, что за период наблюдения, оцениваемые гематологические показатели животного колебались в пределах нормы. Была отмечена тенденция нарастания концентрации эритроцитов и гемоглобина через 48 ч после введения ЛАК. Через 4 ч после введения активированных клеток наблюдали незначительный подъем относительного содержания нейтрофилов в крови, что не отразилось в изменении абсолютного количества этих клеток в кровотоке.
В целом, следует отметить, что поскольку не было отмечено нарастания лейкоцитоза, введение ЛАК в использованной концентрации не вызывало развития системных реакций воспаления или отторжения. Это позволяет сделать вывод об отсутствии у ЛАК гематологической токсичности.
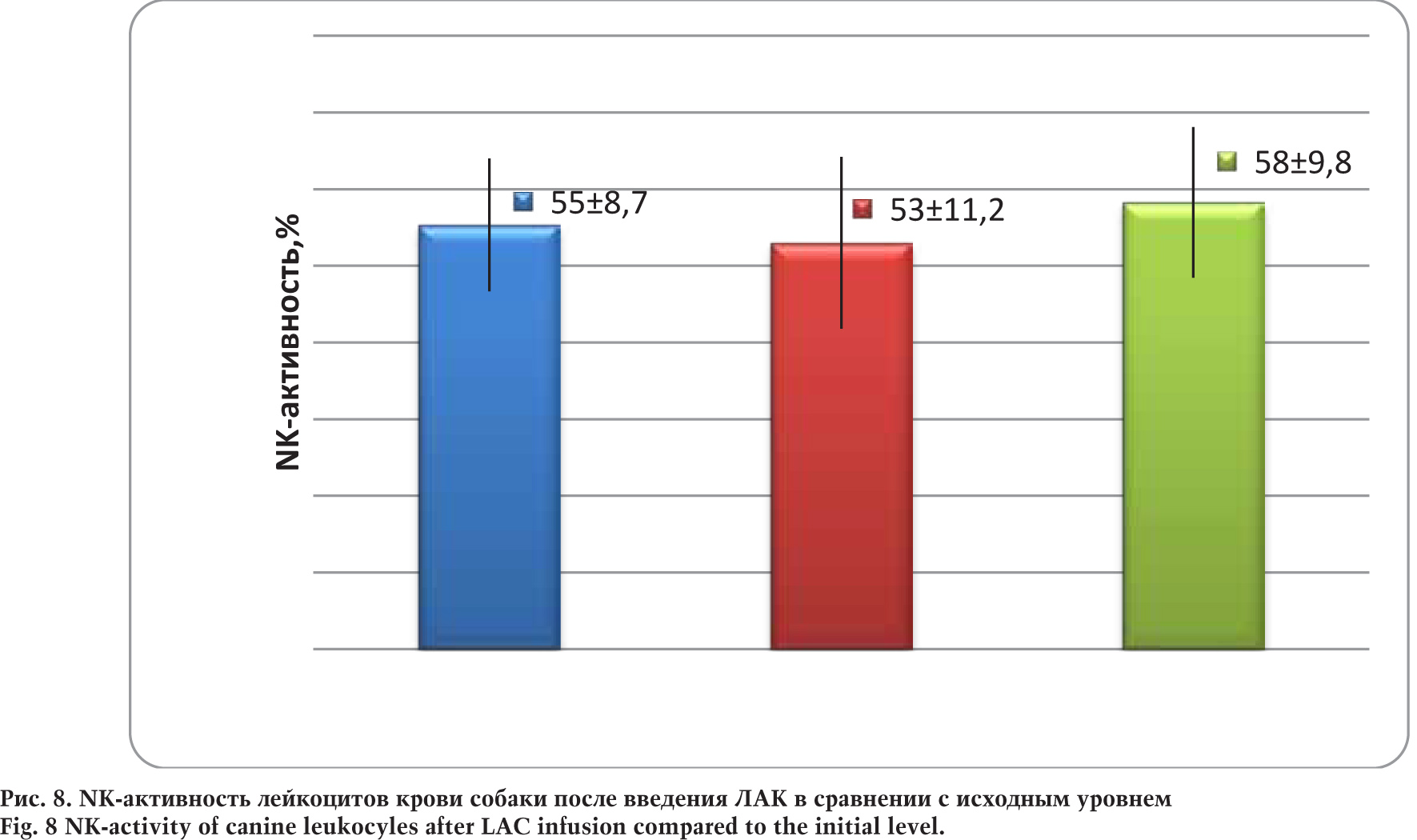
Анализ иммунологических параметров клеток крови собаки проводили параллельно с оценкой гематологических показателей, сравнивая полученные данные с исходным уровнем. Были изучены иммунофенотип клеток крови собаки и активность иммунокомпетентных клеток — неспецифическая противоопухолевая NK-активность и фагоцитарная активность гранулоцитов крови.
Сравнительный анализ показал отсутствие статистически достоверных различий реактивности NK собаки через 4 и 48 ч после введения ЛАК в сравнении с исходным уровнем.
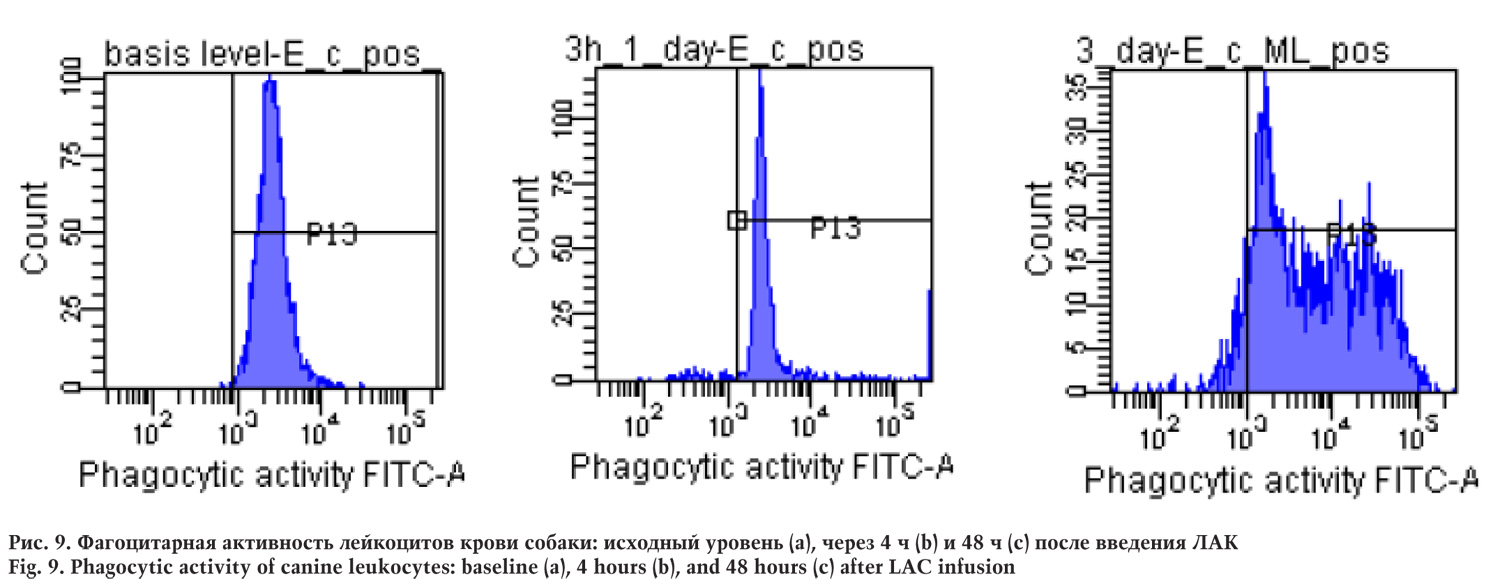
Фагоцитарную активность гранулоцитов собаки оценивали по способности поглощать бактерии E. Coli с использованием проточной цитометрии. Изменений фагоцитарной активности гранулоцитов после введения ЛАК зафиксировано не было.
Фенотип лейкоцитов крови изучали после лизиса эритроцитов с использованием реагента OptiLyse согласно инструкции производителя. На точечном графике, показывающем зависимость прямого светорассеивания от бокового, выделяли гейты субпопуляций лейкоцитов.
Было показано, что уже через 4 ч после введения ЛАК изменяется соотношение CD4 / CD8 субпопуляций лимфоцитов в сторону снижения индекса. Указанный дисбаланс может быть до некоторой степени обусловлен относительно повышенной экспрессией маркера CD8 на мембранах ЛАК, циркулирующих в кровотоке после введения. Уже через 2 суток данный показатель нормализовался. Снижение содержания в крови CD25 лимфоцитов может быть обусловлено относительным уменьшением их концентрации на фоне кратковременного возрастания количества гранулоцитов (см. данные изучения гематологических параметров). Через 48 ч после введения значение этого показателя возросло с 2,8% до 4,9%, что незначительно превышало показатели исходного уровня.
Таким образом, в ходе исследования была проведенатгенерация культуры ЛАК собаки: количество живых клеток составило 323×106 / мл. Клетки были идентифицированы по нарастанию пролиферации Ki67+ клеток, количества CD5+ клеток (Т- и В-лимфоцитов), концентрации Т-киллеров (CD8+ клеток) и активированных клеток (CD25+ клеток), усилению их неспецифической противоопухолевой активности (НК-активности). Полученная аутологичная культура была введена внутривенно, болюсно, медленно собаке породы бигль в количестве 25 млн клеток. Мониторинг физиологических показателей животного продемонстрировал кратковременные колебания в пределах границ нормы температуры тела, усиления ЧСС и ЧД, снижение кровяного давления через 45 минут после введения клеток длительностью 1 ч. В дальнейшем описанные показатели вернулись к исходному уровню. Поскольку анализ гематологических и иммунологических параметров животного в сочетании с результатами рентгенологического исследования не выявил признаков развития каких-либо патологических процессов в организме животного после введения активированных клеток, можно сделать вывод об отсутствии местного или системного токсического воздействия ЛАК в данном количестве.
Выводы
Полученные в ходе проведенного исследования данные представляют интерес и для медицины человека и для ветеринарной медицины, поскольку могут рассматриваться как часть доклинических испытаний готового продукта — суспензии ЛАК, эффективность которой в клинической онкологии человека уже была подтверждена, и как пример оценки безопасности более сложных конструктов на основе активированных иммунокомпетентных клеток, еще находящихся в стадии разработки.
Проведенные исследования могут послужить основой для разработки моделей изучения токсичности средств клеточной противоопухолевой иммунотерапии на основе активированных лейкоцитов (ЛАК, иммунные «checkpointmolecules» и СAR), а также рассматриваться как часть доклинических исследований токсичности ЛАК.
Однако есть сведения о развитии у части пациентов в течение и после инфузии иммунного препарата симптомов «цитокинового шторма» — повышение Т, озноба, нарушения работы дыхательной и сердечнососудистой систем. Поэтому оценке эффективности и применению методов иммунотерапии, как и других терапевтических средств должны предшествовать токсикологические исследования для выяснения доз, режимов и способов введения препаратов.
Конфликт интересов
Авторы не получали спонсорской помощи от производителей препаратов, указанных в данной работе,тили их поставщиков.