Е.А. Корнюшенков1,2, Д.Е. Митрушкин1,2, Д.В. Гаранин2, А.Л. Кузнецова1,2, Е.А. Фатеева1,2, К.В. Лисицкая2, О.С. Елизарова2, К.А. Тихонова2
1Клиника экспериментальной терапии централизованных подразделений ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России (115478 Москва, Каширское шоссе, д. 23).
2Ветеринарная клиника «Биоконтроль» (115478, Москва, Каширское шоссе, д. 24, стр. 10).
РЕЗЮМЕ
Введение. Остеосаркома собак является наиболее распространённой опухолью костей, чаще всего поражающей длинные трубчатые кости. Органосохранные операции представляют собой метод лечения остеосаркомы у собак с сохранением функции конечности.
Цель исследования – анализ выживаемости и случаев рецидивирования остеосаркомы аппендикулярного скелета у собак после органосохранных операций с применением биоимплантатов (деиммунизированных аллогенных костей, заселённых мезенхимальными стромальными клетками реципиента).
Материалы и методы. Группе из 25 собак проводилось комбинированное лечение аппендикулярной остеосаркомы, включавшее химиотерапию цисплатином (60-70 мг/м2, внутривенно, капельно, с интервалом 14-21 день, суммарно до 4 циклов) и широкую сегментарную резекцию поражённой кости с замещением дефекта аллогенным имплантатом, заселённым клеточной культурой аутогенного костного мозга. Оценивались общая выживаемость, выживаемость без прогрессирования и частота местных рецидивов в группе.
Результаты. Медиана общей выживаемости в группе составила 321 день, медиана выживаемости без прогрессирования – 222 дня. Установлено 4 случая местных рецидивов (16,6%), из которых 2 диагноза имеют морфологическое подтверждение, а 2 установлены по клинико-рентгенологическим данным.
Выводы и обсуждение результатов. Эффективность комбинированного органосохранного лечения аппендикулярных остеосарком у собак сравнима с таковой при проведении ампутаций (основываясь на данных научной литературы) и обеспечивает более высокое качество жизни животных.
Ключевые слова: биоимплантат, кость, органосохранная операция, остеосаркома, собака
Сокращения: КТ – компьютерная томография, ЛТ – лучевая терапия, МРТ – магнитно-резонансная томография, ОС – остеосаркома, ХТ – химиотерапия, УЗИ – ультразвуковое исследование.
Введение
Среди опухолей костей у собак наиболее распространённой первичной опухолью является ОС (занимая около 80-85% случаев). Этиология заболевания неизвестна. Предрасположены собаки крупных и гигантских пород, среднего возраста, без половой предрасположенности. Выявлены породы, ассоциированные с высоким риском развития ОС: сенбернар, ирландский волкодав, ирландский сеттер, ротвейлер, немецкая овчарка, доберман-пинчер, боксёр, золотистый ретривер. Приблизительно в 75% случаев ОС поражает аппендикулярный скелет (чаще его метафизы); из них до 40% случаев опухоль локализуется в дистальном сегменте лучевой кости. Данное новообразование характеризуется быстрым ростом (с выраженной костной деструкцией и инвазией в прилежащие мягкие ткани) и очень высоким метастатическим потенциалом. Собак с данным диагнозом без лечения эутаназируют, или они погибают чаще вследствие метастатического поражения лёгких и выраженной болезненности затронутой кости в течение 16-20 недель после постановки диагноза [1, 2, 3, 4].
Ампутация больной конечности длительное время являлась наиболее распространённым (и едва ли не единственным) хирургическим методом лечения. Она имеет целый ряд преимуществ: обеспечивает полное удаление первичной опухоли практически во всех случаях (вследствие чего исключается вероятность рецидива), быстрое облегчение боли, сравнительно короткое время анестезии, низкий риск операционных и послеоперационных осложнений, быструю реабилитацию и относительно невысокую финансовую стоимость. Среднее время выживаемости собак с диагнозом «аппендикулярная ОС» после проведённой ампутации (без ХТ или ЛТ), при отсутствии рентгенологически выявленных метастазов на момент операции, составляет 4 месяца. В настоящее время, комбинированное лечение аппендикулярной ОС посредством хирургии (ампутации или органосохранной операции) и ХТ обеспечивает наибольшую выживаемость таких пациентов (её медиана: 235-366 дней).
Однако ампутация конечности имеет и существенные недостатки. Её нельзя проводить при наличии ортопедической и/или неврологической патологии у какой-либо другой конечности/конечностей или выраженного ожирения. Также отсутствие грудной конечности у крупной или гигантской собаки резко снижает её способность к передвижению. Таким образом, становится актуальным проведение т.н. органосохранной операции [5, 6, 7].
В настоящее время в онкологии применяют следующие методы для реконструкции резецированной кости, пораженной опухолью: металлический протез, наружный чрескостный остеосинтез (с помощью дистракционно-компрессионных аппаратов), интраоперационное экстракорпоральное облучение либо пастеризация собственной кости, поражённой опухолью, транспозиция локтевой кости и аллогенный трансплантат (биоимплантат). Последний представляет собой прошедшую предварительную обработку длинную трубчатую кость, циркулярно фиксируемую металлическими пластинами. Эти методы, в большинстве случаев, позволяют отказаться от выполнения калечащей операции (ампутации) и провести органосохранную операцию, чтобы добиться хорошего или отличного функционирования конечности у 80% собак с аппендикулярной ОС.
Подходящими пациентами для органосохранных операций являются такие собаки, у которых опухоль поражает менее 50% длины кости, отсутствует или имеется минимальная инвазия в прилежащие мягкие ткани, не существует патологический перелом либо признаки метастазирования. Медиана выживаемости при таких операциях у собак сопоставима с медианой выживаемости при ампутации (как с адъювантной ХТ в обоих случаях, так и без неё). Вне зависимости от материала, замещающего кость, в послеоперационном периоде имеется вероятность таких осложнений как несостоятельность имплантата (в 20-40% случаев), инфицирование операционной области (в 30-50% случаев) и рецидив опухоли (до 28% случаев), вследствие чего потребуется реоперация [1, 2, 3, 8, 9, 10, 11, 12].
Целью данного исследования явился анализ выживаемости и случаев рецидивирования ОС аппендикулярного скелета у собак после органосохранных операций с применением биоимплантата (деиммунизированной аллогенной кости, заселённой мезенхимальными стромальными клетками реципиента). Методика получения такого биосовместимого имплантата подробно описана в статье Анисимовой Н.Ю. и соавторов [13]. Суть методики заключается в том, что отпрепарированным от мягких тканей длинным трубчатым костям взрослых эутаназированных собак (вследствие полученных травм, несовместимых с жизнью) проводили перфорацию в трёх участках: в метафизах и центре диафиза. Следующим этапом проводилась их деиммунизация посредством полного погружения в 5-10%-ый раствор, приготовленный из сухой смеси хлорита натрия, перхлората натрия, хлорида натрия в соотношении 7:2:1 и дистиллированной воды в течение 2-4 месяцев. Затем подготовленный костный матрикс многократно промывали стерильным 0,9% раствором хлорида натрия и колонизировали мультипотентными мезенхимальными стромальными клетками, выделенными из костного мозга реципиента.
Материалы и методы
В исследование было включено 25 пациентов, в срок с 2013 по 2017 год получавших лечение в клинике экспериментальной терапии ФГБУ «НМИЦО им Н.Н. Блохина» Минздрава России по поводу ОС аппендикулярного скелета методом органосохранной операции с применением биоимплантата. Возраст животных составлял от 2 до 13 лет, из них в возрасте 2-5 лет – 4 случая, 6-8 лет – 9 случаев, 9-13 лет – 12 случаев. 12 пациентов были самцами, 13 – самками. Породное распределение было следующим: метис – 4 пациента, боксер – 3 пациента, доберман – 3 пациента, американский бульдог – два пациента, ротвейлер – два пациента, бульмастиф – один пациент, дратхаар – один пациент, кане корсо – один пациент, курцхаар – один пациент, маремма – один пациент, московская сторожевая – один пациент, немецкая овчарка – один пациент, ризеншнауцер – один пациент, среднеазиатская овчарка – один пациент, тибетский мастиф – один пациент, черный терьер – один пациент.
Во всех случаях был установлен и морфологически верифицирован диагноз ОС. Стадия заболевания Ia (высокодифференцированная опухоль, не выходящая за пределы надкостницы) установлена у одного животного, стадия IIа (низкодифференцированная опухоль, не выходящая за пределы надкостницы) у одного животного, стадия IIb (низкодифференцированная опухоль, выходящая за пределы надкостницы) у 23. У 15 животных опухоль поражала лучевую кость, у 4 животных – локтевую кость, у 3 животных – большеберцовую кость, у 2 животных – бедренную кость, и у одного животного – плечевую кость.
Всем животным на первом этапе лечения проводилась неоадъювантная ХТ цисплатином в дозе 60-70 мг/м2 внутривенно капельно с интервалом 14-21 день, всего 1-2 цикла. В дальнейшем у всех пациентов выполнялась органосохранная хирургическая операция в объеме широкой сегментарной резекции пораженной кости (граница резекции формировалась с зоной безопасности в 3 см от видимых границ опухоли), с последующим замещением дефекта аллогенным биоимплантатом (рисунки 1-5).

Рис. 1. Рентгенограмма левой тазовой конечности в боковой проекции. Остеодеструкция кортекса, выраженная периостальная реакция по игольчатому типу в дистальном сегменте левой большеберцовой кости

Рис. 2. Интраоперационная фотография. Широкая сегментарная резекция дистального сегмента костей левой голени

Рис. 3. Интраоперационная фотография. Замещение дефекта дистального сегмента левой голени биоимплантатом. Артродез скакательного сустава и остеосинтез левой большеберцовой кости динамическими компрессионными пластинами

Рис. 4. Рентгенограмма левой тазовой конечности в боковой проекции через два месяца после операции. Биоимплантат левой большеберцовой кости, фиксированный двумя динамическими компрессионными пластинами

Рис. 5. Функциональный результат через один год после сохранной операции по поводу остеосаркомы
В послеоперационном периоде проводилась адъювантная ХТ цисплатином в дозе 60-70 мг/м2 внутривенно капельно с интервалом 14-21 день, суммарно до 4 циклов с учетом неоадъювантного этапа лечения. При необходимости проводилась сопроводительная терапия препаратами железа, эритропоэтина, колониестимулирующих факторов, симптоматическая терапия.
После окончания лечения пациенты выписывались с рекомендациями по динамическому наблюдению, включающему в себя периодический осмотр, клиническое обследование, рентгенографию или КТ легких, УЗИ органов брюшной полости для контроля локального статуса и развития отдаленных метастазов.
Результаты
В процессе наблюдения опорная функция конечности у 20 пациентов (80%) оценивалась как хорошая или отличная. Не было зафиксировано ни одного случая реакции отторжения аллогенного трансплантата.
На момент исследования у 17 пациентов методами клинического, инструментального обследования или при аутопсии выявлены признаки местного рецидива или метастазирования ОС. Из них местный рецидив в зоне операции зафиксирован у 4 пациентов, метастазирование в легкие – у 9 пациентов, метастазирование в кости – у 4 пациентов, метастазирование в печень – у 2 пациентов и метастазирование в регионарные лимфатические узлы – у одного пациента.
Клиническими признаками местного рецидивирования являлась вновь возникшая или усиливающаяся хромота на оперированную конечность, визуально и пальпаторно определяемое объёмное образование мягкотканной или костной плотности в зоне первичной опухоли или прилежащих к ней отделах конечности. Рентгенологическими признаками рецидива являлась визуализация объёмного образования в послеоперационной области мягкотканной или костной плотности, с признаками остеодеструкции, наличием периостальной реакции и патогномоничных рентгенологических симптомов, характерных для опухоли кости (рисунок 6). Морфологическая верификация местного рецидива проводилась только по данным аутопсии погибших животных.
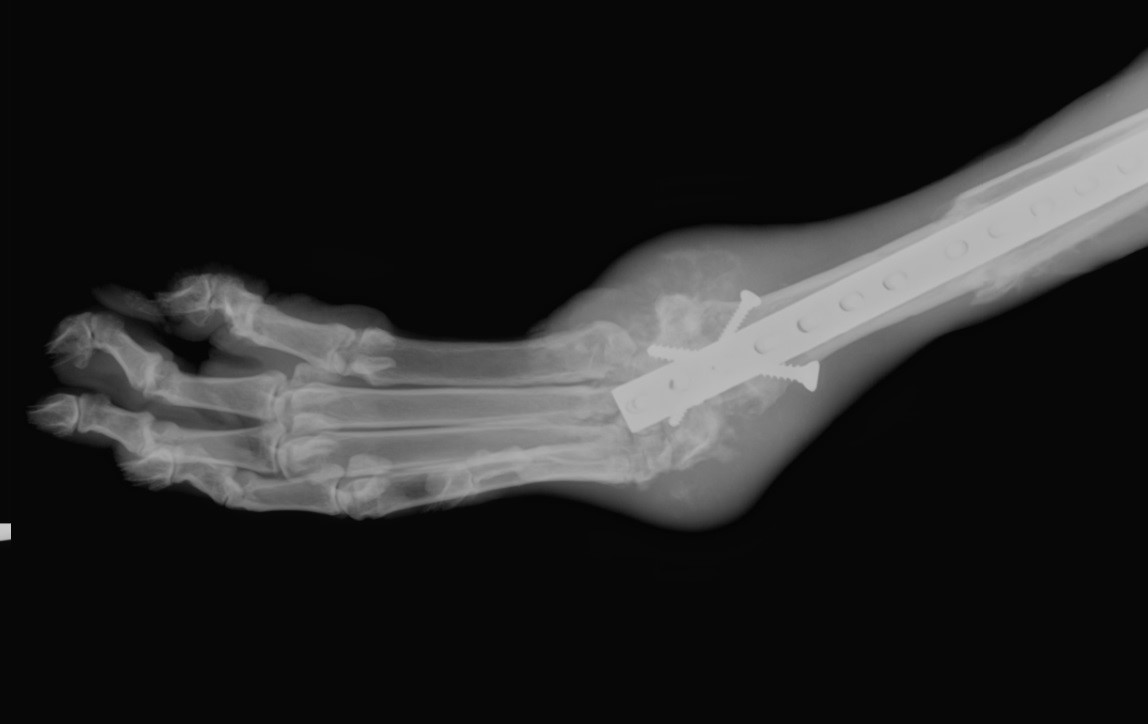
Рисунок 6. Рентгенограмма грудной конечности в прямой проекции. Местный рецидив ОС в двух участках: периостальная реакция и остеодеструкция в области дистального сегмента биоимпланта и запястья; периостоз в области диафиза лучевой кости
21 пациент на момент исследования умер либо эутаназирован, из них 6 животным выполнена аутопсия. По результатам патологоанатомического исследования установлено, что у трёх животных гибель наступила по причинам, не связанным с основным заболеванием, при этом у двух пациентов на патологоанатомическом вскрытии признаков местного рецидива и метастазов ОС обнаружено не было. В числе животных, не подвергшихся патологоанатомическому исследованию после смерти, следует выделить два случая, когда гибель наступила с клиникой хронической почечной недостаточности без установленных признаков местного рецидива или прогрессирования онкологического процесса.
На момент исследования 4 животных живы, признаков местного рецидива и метастазирования ОС на момент последнего обследования выявлено не было.
Статистическая обработка полученных данных проводилась с помощью программы Statsoft Statistica.
Были проанализированы показатели общей выживаемости и выживаемости без прогрессирования в группе методом Каплана-Майера. Для общей выживаемости в качестве критерия цензурирования данных использовались случаи, в которых животное было живо на момент исследования, а для выживаемости без прогрессирования – случаи, в которых у пациента на момент последнего обследования отсутствовали признаки местного рецидива, регионарных или отдаленных метастазов ОС. Для общей выживаемости критерии цензурирования были дополнены случаями гибели животного от сопутствующей патологии, а для выживаемости без прогрессирования – только теми случаями, когда при аутопсии не было обнаружено ни рецидивной опухоли, ни метастазов остеосаркомы.
Была вычислена скорректированная по Каплану-Майеру медиана и квартили общей выживаемости и выживаемости без прогрессирования в группе. Медиана общей выживаемости в группе составила 321 день, 25-й процентиль составил 184 дня, 75-й процентиль — 605 дней. Медиана выживаемости без прогрессирования в группе составила 222 дня, 25-й процентиль — 129 день, 75-й процентиль — 548 дней.
Результаты анализа выживаемости пациентов по Каплану-Майеру представлены на рисунках 7 и 8.
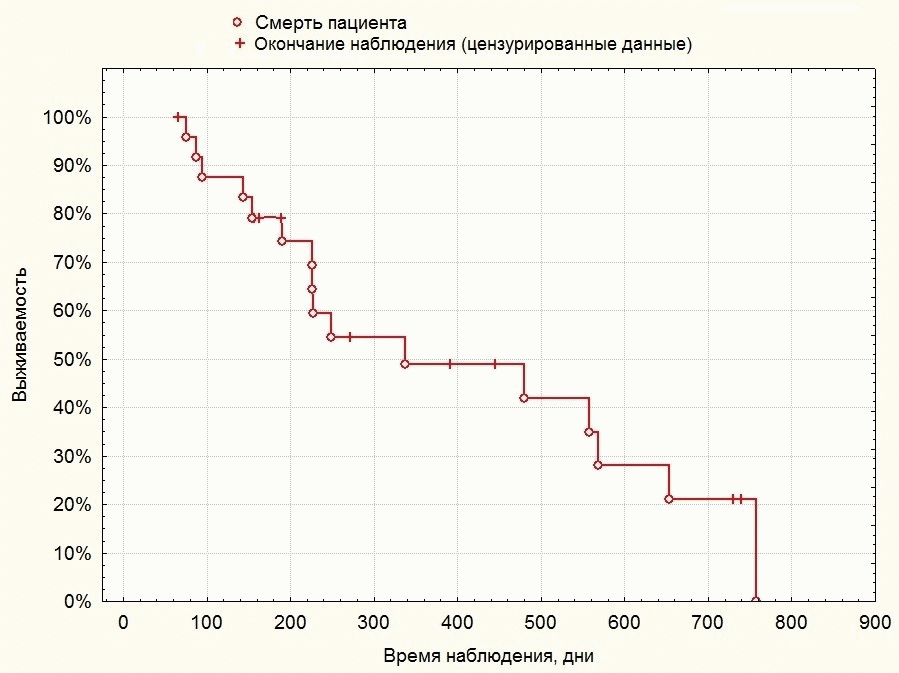
Рисунок 7. Общая выживаемость в группе пациентов после органосохранного лечения остеосаркомы.
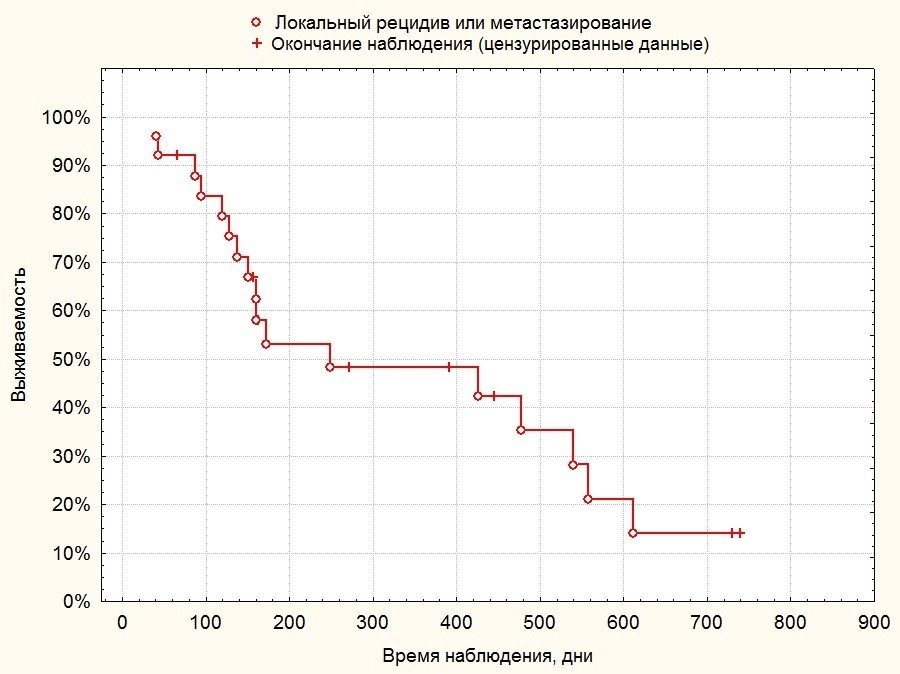
Рисунок 8. Выживаемость без прогрессирования в группе пациентов после органосохранного лечения остеосаркомы.
На момент фиксации результатов исследования у 4 пациентов методами клинического, инструментального обследования или при аутопсии выявлены признаки местного рецидива ОС; из них у трёх животных рецидив выявлен прижизненно и у одного пациента – на аутопсии. В двух случаях принадлежность рецидивной опухоли установлена морфологически, и в двух случаях – клинико-рентгенологическими методами. У 3 животных местный рецидив констатирован в лучевой кости, у одного животного – в большеберцовой кости. К настоящему времени все пациенты с установленным местным рецидивом умерли или эутаназированы.
Мы проанализировали безрецидивную выживаемость в группе с учетом только местных рецидивов методом Каплана-Майера. В качестве критерия цензурирования данных использовались случаи, в которых животное на момент окончания наблюдения или смерти не имело ни клинических, ни рентгенологических, ни морфологических признаков местного рецидива. Результаты анализа представлены на рисунке 9.

Рисунок 9. Безрецидивная выживаемость в группе пациентов после органосохранного лечения ОС.
Выводы и обсуждение результатов
Полученные результаты позволяют оценить общую и безрецидивную выживаемость пациентов как сравнимую с данными иностранных исследователей, при этом качество жизни животных после органосохранной операции в целом выше по отношению к качеству жизни животных, подвергнутых ампутации конечности. Анализ графиков выживаемости также позволяет отметить, что приблизительно у 50% пациентов отмечается прогрессирование заболевания в течение первых 150 дней после операции, вероятно, по причине наличия у них недиагностированных микрометастазов на момент первичного приема. У пациентов, переживших этот срок, фиксируется «вторая волна» рецидивов по прошествии 400-600 дней (1-1,5 года); таким образом, показатель однолетней безрецидивной выживаемости составляет 49%, а 2-летней — около 15%. При этом однолетняя общая выживаемость животных (составляя 50%) лишь незначительно превышает безрецидивную, а 2-летняя общая выживаемость составляет 21%.
При анализе графика частоты местного рецидивирования также можно предположить зависимость, сходную с указанной выше для прогрессирования заболевания: местные рецидивы фиксировались либо в течение первых 150 дней (50% случаев), либо по истечении второго года наблюдения. В целом, частоту местного рецидивирования после комбинированного лечения ОС собак способом, указанным выше, можно оценить как небольшую (16,6%).
СПИСОК ЛИТЕРАТУРЫ
- Mitchell K.E., Boston S.E., Kung M., Dry S., Straw R.C., Ehrhart N.P., Ryan S.D. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study. Vet Surg. 2016 Jan; 45(1):36-43. DOI: 10.1111/vsu.12423. PMID: 26731595.
- MacDonald T.L., Schiller T.D. Limb-sparing surgery using tantalum metal endoprosthesis in a dog with osteosarcoma of the distal radius. Can Vet J. 2010 May; 51(5): 497–500. PMID: 20676291.
- Jehn C., Farese J., Lewis D. et al. Current treatment options for dogs with appendicular osteosarcoma. Vet Med 2005; 100:295–305.
- Gassel A., Bilbrey S. Limb-sparing surgery for appendicular osteosarcoma in dogs. Vet Med. 2003; 98:119–124.
- Jehn C., Farese J., Lewis D. et al. Current treatment options for dogs with appendicular osteosarcoma. Vet Med. 2005; 100:295–305.
- Morello E., Buracco P., Martano M. et al. Bone allografts and adjuvant cisplatin for the treatment of canine appendicular osteosarcoma in 18 dogs. J Small Anim Pract. 2001 Feb; 42(2):61-6. PMID: 11263699.
- Lascelles B.D., Dernell W.S., Correa M.T. et al. Improved survival associated with postoperative wound infection in dogs treated with limb-salvage surgery for osteosarcoma. Ann Surg Oncol. 2005 Dec; 12(12):1073-83. DOI:10.1245/ASO.2005.01.011. PMID: 16252138.
- M. Szewczyk, R. Lechowski, K. Zabielska. What do we know about canine osteosarcoma treatment? Review. // Vet Res Commun. ― 2015 Mar. ― No. 39(1). ― pp. 61‒67.
- Корнюшенков Е.А., Голуб Л.В., Анисимова Н.Ю. и др. Новые пути решения проблемы замещения дефектов при обширной резекции у животных с опухолями костей. Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2013; 3: 12-16.
- Liptak J.M., Dernell W.S., Ehrhart N. et al. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques. Vet Surg. 2006 Aug; 35(6):518-33. DOI: 10.1111/j.1532-950X.2006.00185.x. PMID: 16911152.
- MacDonald T.L., Schiller T.D. Limb-sparing surgery using tantalum metal endoprosthesis in a dog with osteosarcoma of the distal radius. Can Vet J. 2010 May; 51(5): 497‒500. PMID: 20676291.
- Withrow S.J., Liptak J.M., Straw R.C. et al. Biodegradable cisplatin polymer in limb-sparing surgery for canine osteosarcoma. Ann Surg Oncol. 2004 Jul; 11(7):705-13. DOI: 10.1245/ASO.2004.10.008. PMID: 15231525.
- Анисимова Н.Ю., Копылов А.Н., Корнюшенков Е.А. и др. Стерильный деиммунизированный матрикс для замещения расширенных дефектов костной ткани. Саркомы костей, мягких тканей и опухоли кожи. 2013. №2. Стр. 49-54.
Сведения об авторах
Корнюшенков Евгений Александрович, кандидат биологических наук, заведующий клиникой экспериментальной терапии централизованных подразделений ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина», главный врач ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: evg-kornyushenkov@yandex.ru, SPIN-код 4814-1327, ORCHID 0000-0002-3903-8773.
Митрушкин Дмитрий Евгеньевич, кандидат биологических наук, старший научный сотрудник клиники экспериментальной терапии централизованных подразделений ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина», врач-патоморфолог ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: 89035718861@mail.ru, SPIN-код 9119-0672.
Гаранин Дмитрий Валентинович, кандидат биологических наук, ведущий хирург ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: dmi-garanin@yandex.ru.
Кузнецова Анна Леонидовна, кандидат биологических наук, старший научный сотрудник клиники экспериментальной терапии централизованных подразделений ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина», ведущий онколог ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: kyzma22@list.ru, SPIN-код 1124-0660.
Фатеева Екатерина Анатольевна, кандидат ветеринарных наук, старший научный сотрудник клиники экспериментальной терапии централизованных подразделений ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина», руководитель отделения реабилитации ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: katarina-vet@mail.ru.
Лисицкая Ксения Валерьевна, кандидат биологических наук, врач-морфолог ветеринарной клиники «Биоконтроль», г.Москва, Россия. E-mail: , SPIN-код 4483-2792.
Елизарова Ольга Сергеевна, ассистент ветеринарного врача ветеринарной клиники «Биоконтроль», г.Москва, Россия.
Тихонова Ксения Александровна, ассистент ветеринарного врача ветеринарной клиники «Биоконтроль», г.Москва, Россия.
REFERENCES
- Mitchell K.E., Boston S.E., Kung M., Dry S., Straw R.C., Ehrhart N.P., Ryan S.D. Outcomes of Limb-Sparing Surgery Using Two Generations of Metal Endoprosthesis in 45 Dogs With Distal Radial Osteosarcoma. A Veterinary Society of Surgical Oncology Retrospective Study. Vet Surg. 2016 Jan; 45(1):36-43. DOI: 10.1111/vsu.12423. PMID: 26731595.
- MacDonald T.L., Schiller T.D. Limb-sparing surgery using tantalum metal endoprosthesis in a dog with osteosarcoma of the distal radius. Can Vet J. 2010 May; 51(5): 497–500. PMID: 20676291.
- Jehn C., Farese J., Lewis D. et al. Current treatment options for dogs with appendicular osteosarcoma. Vet Med 2005; 100:295–305.
- Gassel A., Bilbrey S. Limb-sparing surgery for appendicular osteosarcoma in dogs. Vet Med. 2003; 98:119–124.
- Jehn C., Farese J., Lewis D. et al. Current treatment options for dogs with appendicular osteosarcoma. Vet Med. 2005; 100:295–305.
- Morello E., Buracco P., Martano M. et al. Bone allografts and adjuvant cisplatin for the treatment of canine appendicular osteosarcoma in 18 dogs. J Small Anim Pract. 2001 Feb; 42(2):61-6. PMID: 11263699.
- Lascelles B.D., Dernell W.S., Correa M.T. et al. Improved survival associated with postoperative wound infection in dogs treated with limb-salvage surgery for osteosarcoma. Ann Surg Oncol. 2005 Dec; 12(12):1073-83. DOI:10.1245/ASO.2005.01.011. PMID: 16252138.
- M. Szewczyk, R. Lechowski, K. Zabielska. What do we know about canine osteosarcoma treatment? Review. // Vet Res Commun. ― 2015 Mar. ― No. 39(1). ― pp. 61‒67.
- Kornyushenkov E.A., Golub L.V., Anisimova N.Yu., Kisilevsky M.V., Glazov N.A., Maximkin A.V., Kuznetsova A.L., Shimshirt A.A., Mitrushkin D.E., Musaev E.R., Sushentsov E.A. New Methods for Solving the Problem of Defect Replacement in Case of Extensive Resection of Bone Tumors in Animals. Russian Veterinary Journal: Small pets and wild animals. 2013; 3: p. 12-16.
- Liptak J.M., Dernell W.S., Ehrhart N. et al. Cortical allograft and endoprosthesis for limb-sparing surgery in dogs with distal radial osteosarcoma: a prospective clinical comparison of two different limb-sparing techniques. Vet Surg. 2006 Aug; 35(6):518-33. DOI: 10.1111/j.1532-950X.2006.00185.x. PMID: 16911152.
- MacDonald T.L., Schiller T.D. Limb-sparing surgery using tantalum metal endoprosthesis in a dog with osteosarcoma of the distal radius. Can Vet J. 2010 May; 51(5): 497‒500. PMID: 20676291.
- Withrow S.J., Liptak J.M., Straw R.C. et al. Biodegradable cisplatin polymer in limb-sparing surgery for canine osteosarcoma. Ann Surg Oncol. 2004 Jul; 11(7):705-13. DOI: 10.1245/ASO.2004.10.008. PMID: 15231525.
- Anisimova N.Yu., Kopylov A.N., Kornyushenkov E.A. Mitrushkin D.E., Maximkin A.V., Sushenzov E.A., Kiselevsky M.V. The sterile deimmunized matrix for the replacement of extended defects in bone. Bone and soft tissue sarcomas and tumors of the skin. 2013. №2. pp. 49-54.
